
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe 2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe 3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+ =4Fe3+ +2H2O,则另一反应的离子方程式为_________________;
(2)草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:

①配制(NH4) 2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是___________________。
②得到的草酸亚铁沉淀需充分洗涤,洗涤操作的具体方法为_________________________________,检验是否洗涤干净的方法是___________________________。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A→B发生反应的化学方程式为:__________________________________。
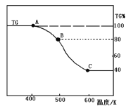
②已知 B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式____________;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g 样品,溶于少量2mol/L 硫酸中并用 100mL 容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V 1 mL。
Ⅲ.向上述溶液中加入足量 Zn 粉,使溶液中的 Fe3+恰好全部还原为 Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V 2 mL。
已知:2MnO4- +5H2C2O 4+6H+=2Mn2+ +10CO2+8H2O
MnO4- +8H++5Fe2+ =5Fe3+ + Mn2+ +4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量(填―偏大‖、―偏小‖或―不变‖)。
②mg样品中草酸根离子的物质的量为(用 c,V1,V2的式子表示,不必化简)。
【答案】(1)2 Fe3++SO2+2H2O=2 Fe2+ +SO42- +4H+;
(2)①抑制Fe2+和NH4+离子水解; ②沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复 2-3 次;取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①FeC2O4·2H2O![]() FeC2O4 +2H2O(2分)②FeC2O4
FeC2O4 +2H2O(2分)②FeC2O4![]() FeO+CO2↑+CO↑;
FeO+CO2↑+CO↑;
(4)①偏大②(cV1– cV2)×10 -3 ×5/2×5mol
【解析】
试题分析:(1)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+;
(2)①因 NH4+和Fe2+水解使溶液显酸性,则配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,其目的是抑制Fe2+和NH4+离子水解。②洗涤沉淀的方法是:沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复 2-3 次;因溶液中含有 SO42-,能与Ba2+生成不溶于酸的 BaSO4沉淀,故检验沉淀是否洗净的方法是:取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①由图可知,加热生成 B时,剩余物体为 80%,损失20%,FeC2O4·2H2O中结晶水的质量分数为 36/180×100%=20%,故 A→B 发生的反应是FeC2O4·2H2O 加热失去结晶水,反应的化学方程式为 FeC2O4·2H2O ![]() FeC2O4+2H2O;②已知 B→C 过程中有等物质的量的两种气态氧化物生成,根据原子守恒可知两种氧化物是CO和 CO2,由图可知,加热生成 C 时,分解完全,假定草酸盐铁晶体为 180g,其物质的量为 1mol,则C固体的质量为 180g×40%=72g,铁元素的质量为 56g,故应含氧元素的质量为 72g-56g=16g,氧原子的物质的量为1mol ,所以固 体 C为 FeO, B→C 的化 学 方 程 式 为FeC2O4
FeC2O4+2H2O;②已知 B→C 过程中有等物质的量的两种气态氧化物生成,根据原子守恒可知两种氧化物是CO和 CO2,由图可知,加热生成 C 时,分解完全,假定草酸盐铁晶体为 180g,其物质的量为 1mol,则C固体的质量为 180g×40%=72g,铁元素的质量为 56g,故应含氧元素的质量为 72g-56g=16g,氧原子的物质的量为1mol ,所以固 体 C为 FeO, B→C 的化 学 方 程 式 为FeC2O4 ![]() FeO+CO2↑+CO↑。
FeO+CO2↑+CO↑。
(4)①若省略步骤Ⅳ,则与Fe2+反应的高锰酸钾减少,因此与草酸根反应的高锰酸钾增加,则测定的草酸根离子的含量偏大;②与 Fe2+反应的高锰酸钾的物质的量为0.001cV2mol,则与草酸根反应的高锰酸钾的物质的量为(cV1-cV2)×10-3mol,根据方程式可知草酸根的物质的量为(cV1-cV2)×10-3×5/2mol,则 m g 样品中草酸根离子的物质的量为(cV1- cV2)×10-3×5/2×5mol。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:
用10mL H2O2制取150mLO2所需的时间(秒)
反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 260 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(1)该小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响。
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
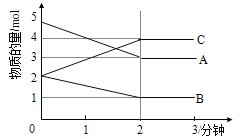
(3)该反应的的化学方程式为 。
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。

(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)C装置的作用 。
(4)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是 。
A.A中反应不完全
B.E中碱石灰会吸收空气中的CO2和H2O
C.反应生成的SO2部分被E中碱石灰吸收
D.反应完全后,还有CO2气体滞留在装置体系中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同, A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1) B、C、D三种元素中电负性最大的元素其基态原子的电子排布图为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有________个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为______。该化合物的电子式为 。

(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。
②由H分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向可变容积的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡后,容器的体积为4L,试回答下列问题:
2NH3(g) △H<0达到平衡后,容器的体积为4L,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K = ,若降低温度,K值将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将___(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将 (填“增大”“减小”或“不变”),理由是___________________________。
(3) 达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将________(填“增大”、“减小”或“不变”)。
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图。下列说法正确的是 (填序号)。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2

(5)常压下,把H2和用He稀释的N2分别通入一个570℃的电解池装置(下图),H2和N2便可在电极上合成氨,装置中的电解质(图中黑细点处)能传导H+,则阴极的电极反应式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的 (填“Na2O”或“Na2O2”);
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种 (填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时AgBr在水中的沉淀溶解平衡曲线如图所示。t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A.在t℃时,AgBr 的 Ksp为4.9×10-13
B.在 t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数 K≈816
AgBr(s)+Cl-(aq)的平衡常数 K≈816
C.图中a点对应的是AgBr的不饱和溶液
D.在 AgBr 饱和溶液中加入NaBr固体,可使溶液由c点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬顿( Fenton )试例,成分为双氧水和亚铁盐,需要酸性环境。电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图2所示.其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+·OH,生成的羟基自由基(·OH)对有机物有极强的氧化能力。下列说法正确的是

A.a极是电源的正极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-=·OH+H+
D.消耗1molO2,可以产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修22:化学生活与技术]氯碱工业过程中产生了大量的盐泥。某氯碱工厂的盐泥组成如下:
成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
该工厂进一步利用盐泥生产了七水硫酸镁,设计了工艺流程如图:

回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式 。
(2)在滤饼中检测到硫酸钙的成分,其原因是 。
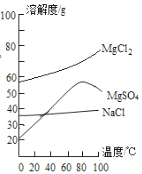
(3)已知一些盐的溶解度如下图。在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在__________℃。
(4)步骤II操作是_______________,
(5)步骤III在工业上常用的设备是______________(填字母)。
A.加压干燥器 B.蒸馏塔 C.离心机 D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4·7H2O的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com