
石膏也可用于工业生产二氧化硫,进而生产硫酸。天然石膏的化学式为CaSO4·2H2O。将天然石膏脱水后,第2步化学反应就可制得二氧化硫。
(1)写出第1步反应的化学方程式__________________________________。
(2)在第2步化学反应中,下列原料可以使用的是(用序号填空)__________。
写出有关化学反应的方程式_________________________________________
_________________________________________________________________。
①空气 ②氧气 ③硫酸 ④焦炭
(3)在第2步化学反应中,可能会排入空气的气态污染物是________。它(或它
们)的主要危害是__________________________________________________
_________________________________________________________________。
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO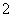 +4NH
+4NH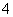 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O ,反应结束后锌没有剩余,则反应中被还原的硝酸与未被还原的硝酸的物质的量之比为 ( )
A.1:4 B.1:5 C.2:3 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解精炼铜的叙述中不正确的是()
A. 粗铜板:阳极
B. 电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e﹣═Cu
C. 粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D. 电解铜的纯度可达99.95%﹣99.98%
查看答案和解析>>
科目:高中化学 来源: 题型:
含Cr2O72﹣的工业酸性废水会造成铬污染,排放前要进行如下处理:(Ⅰ)往工业废水中加入适量的NaCl搅拌均匀;(Ⅱ)以Fe做两电极进行电解,从而使溶液的pH不断升高,废水由酸性转化为碱性,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生:(Ⅲ)过滤回收沉淀,废水达到排放标准.
(1)在电解过程中,溶液pH不断升高的原因可能是
①电解时废水的体积不断减小 ②电解时H+在阴极被还原 ③作为阳极的Fe不断溶解 ④Cr2O72﹣转化为Cr3+时消耗了H+ ⑤NaCl在电解时转化成了NaOH
A.⑤B.②④C.②③④D.①②③④
(2)两极发生反应的电极反应式为
阳极: ;阴极: .
(3)写出Cr2O72﹣变成Cr3+的离子方程式 .
(4) (填“能”或“不能”)改用石墨电极进行电解.
查看答案和解析>>
科目:高中化学 来源: 题型:
工业接触法制硫酸的简单流程图如下:
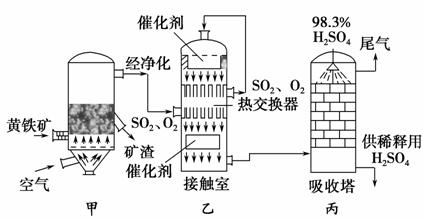
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是____________________________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是________________________________________________,
________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于0.1 mol·L-1Na2CO3溶液的叙述中错误的是 ( )
A.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol·L-1
B.1 L该溶液中含有Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为
0.01 mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一种酸性溶液中,可能存在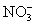 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
A.一定有碘离子 B.可能含铁离子
C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的是( )
|
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 原子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com