
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
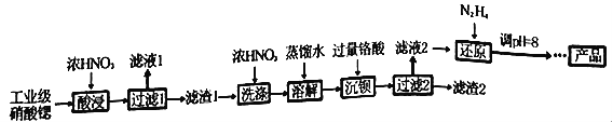
已知:①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为 BaCrO4(杂质不与硝酸反应)。②铬酸(H2CrO4)为弱酸。
(1)“酸浸”不能采用高温的原因是_________________________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_________________________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式_______________________________________________________。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是:___________。(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中 BaCrO4的含量,进行以下实验:
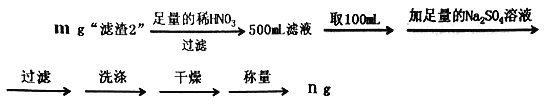
①判断Ba2+完全沉淀的方法:____________________________________________。
②“滤渣2”中BaCO4的质量分数为______________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则说明含水
②除 去乙醇中微量的水可加入金属钠,使其完全反应
③加热蒸馏含水的乙醇可获得无水乙醇
④在含 少量水的乙醇中加入石灰,然后再加热蒸馏可以获得无水乙醇
A.①③B.②④C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a%的某物质的水溶液加热蒸发掉mg水(溶质不挥发、且蒸发过程无溶质析出),所得溶液体积为VL,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为( ) mol·L-1。
A.![]() MVB.
MVB.![]() MVC.
MVC.![]() MVD.
MVD.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试管中,不同条件下反应:Fe+2HCl=FeCl2+H2↑,判断产生H2的反应速率最小的是
试管 | 盐酸浓度 | 温度 | 铁的状态 |
A | 0.5 mol/L | 20 ℃ | 块状 |
B | 0.5 mol/L | 20 ℃ | 粉末状 |
C | 2 mol/L | 35 ℃ | 粉末状 |
D | 1 mol/L | 35 ℃ | 块状 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.76g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2气体1792mL(标准状况),向反应后的溶液中加入适量的1.0 mol/LNaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
B. 浓硝酸在反应中表现了氧化性和酸性,且表现氧化性的硝酸的物质的量为0.08 mol
C. 得到沉淀的质量为3.12g
D. 加入NaOH溶液的体积是50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化,通常主要表现为热量的变化——吸热或者放热。下列有关说法不正确的是
A. 氢气在氧气中燃烧和在空气中燃烧都是放热反应
B. 煤的燃烧需要加热点燃,故是吸热反应
C. 放热反应的反应物的总能量高于生成物的总能量
D. 煅烧石灰石制生石灰是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如图所示。
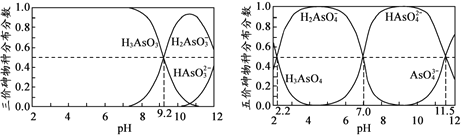
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 _____________________。 ②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH________0(填“>”或“<”)。
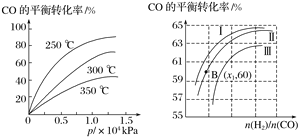
图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=__________。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com