
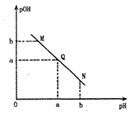
 某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )
某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N 点所示溶液中 c(CH3COO-)>c(Na+) | |
| C. | Q点消耗NaOH溶液的体积等于醋酸溶液的体积 | |
| D. | M点和N点所示溶液中水的电离程度相同 |
分析 酸溶液中pOH越大,说明溶液中氢氧根离子浓度越小,溶液氢离子浓度越大,酸性越强,随着NaOH的加入,发生中和反应,溶液氢氧根离子的浓度逐渐增大,则溶液pOH逐渐减小,pH逐渐增大,结合弱电解质的电离解答该题.
解答 解:A.M点主要是醋酸,Q点主要是醋酸钠,由于醋酸是弱酸,电离程度很小,离子浓度也较小,所以M点所示溶液的导电能力弱于Q点,故A错误;
B.N点所示溶液为碱性,则c(OH-)>c(H+),根据溶液电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),可判断出此时c(Na+)>c(CH3COO-),故B错误;
C.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,故C错误;
D.由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故D正确.
故选D.
点评 本题考查酸碱中和的定性判断和计算,侧重于弱电解质的电离的考查,注意弱电解质的电离特点,把握pOH的含义,题目难度中等,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
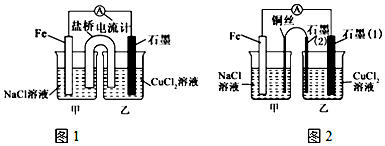
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与锌粒反应:Cu2++Zn=Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com