
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32-
C.无色溶液:Ba 2+、Na+、MnO4-、NO3-
D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请同学们 写出三个有关的化学方程式:
(1)________________________________________________________________________;
(2)________________________________________________________________________;
(3)________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是__________;滤渣可循环使用,滤渣的主要成分是________(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致__________________;若n(NO)∶n(NO2)<1∶1,则会导致_________________。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为_______________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,满足表中图示物质在通常条件下能一步转化的组合只有( )
| 序号 | X | Y | Z | W |
|
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③ B.①③④
C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

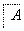


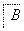
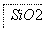
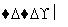

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:________________
(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为________________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液
c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、________(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
 Fe2++
Fe2++ ClO-+
ClO-+ __________===
__________=== Fe(OH)3↓+
Fe(OH)3↓+ Cl-+
Cl-+ ________
________
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为________(填代号)。
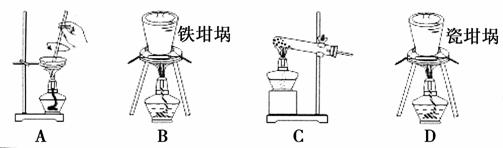
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源。工业上利用煤的气化产物(水煤气)合成甲醇和二甲醚。回答下列问题:
(1)制备二甲醚最后一步反应由Al2O3催化甲醇脱水合成,反应方程式为 。
(2)已知:CO(g)+2H2(g)=CH3OH (g) △H= —90.1kJ·mol-1
CO(g)的燃烧热是282.8 kJ·mol-1;H2的燃烧热是285.8 kJ·mol-1
写出表示CH3OH (g) 燃烧热的热化学反应方程式 。
(3)二甲醚直接燃料电池比甲醇直接燃料电池更高效,等质量的二甲醚和甲醇完全放电转移电子的物质的量之比是 。用二甲醚直接燃料电池电解足量饱和食盐水,当消耗9.2g二甲醚时理论上阴极产生的气体的体积为 L。(标况下)
(4)在合成中伴有水煤气交换反应:CO(g)+H2O(g)  CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
| 温度 | 260℃ | 280℃ | 295℃ | 310℃ |
| CO转化率 | 89% | 80% | 75% | 60% |
①请解释CO转化率随温度变化的关系 。
②列式计算280℃时平衡常数 。
③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使温度 (填“升高”、“降低”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱 工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

(1)写出下列物质的化学式:B____________、G_____________________________、Y______________。
(2)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则E是__________极,请写出在此电极上发生的电极反应式:
________________________________________________________________________。
(3)写出反应①的化学方程式______________________________________________。
(4)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×10-39。将
0.01 mol·L-1的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀________(填“能”或“不能”),请通过计算说明___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水)不能确定的物理量是________。
①1摩尔水的质量 ②1摩尔水蒸气的质量 ③1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
只含C、H两种元素的有机物X、Y,若X中含C质量分数为75%,Y中含C质量分数为85.7%,则X、Y的分子式可能是
A.CH4、C2H4 B.CH4、C2H6 C.C2H4、C2H6 D.CH4、C3H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com