̼���仯���������������������е�Ӧ�÷dz��㷺������̼�������ֻ��һ�����룬����һ��ֵ���ڴ������ʽ��
��1����֪����2CH
4��g��+3O
2��g��?2CO��g��+4H
2O��l����H
1=-1214.6kJ/mol
��2CO��g��+O
2��g��?2CO
2��g����H
2=-566kJ/mol��
�������������Ӧ���ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ
��
��2����֪�ں��º�ѹ���ܱ������Ŀ��淴ӦCH
4��g��+H
2O��g��?CO��g��+3H
2��g��
�ٸÿ��淴Ӧһ���ﵽƽ��ı�־��
��
A��v��CH
4��
��=3v��H
2��
�� B��ˮ������Ũ����һ����̼��Ũ�����
C��ƽ����Է�����������ʱ��ı仯���仯 D���ܶȲ���ʱ��ı仯���仯
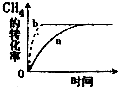
�ڸÿ��淴Ӧ�ڲ�ͬ�����£����CH
4ת������ʱ��仯��ͼ��ʾ����ʵ��a��ȣ�b��ʵ��������
��
��3������ͬ���ʵ�����CO��g����H
2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У�
���з�Ӧ��CO��g��+H
2O��g��?CO
2��g��+H
2��g������H�õ������������ݣ�
| �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min |
| H2O | CO | H2 | CO2 |
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
��ʵ��1����v��H
2����ʾ�ķ�Ӧ����Ϊ
��
��ʵ��2�е�ƽ�ⳣ����
��������������λС������
�۸÷�Ӧ�ġ�H
0���������������
����ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬���������ʵ����������ֱ���ȣ�����a��bӦ����Ĺ�ϵ��
���ú�a��b��ʽ�ӱ�ʾ����

 ̼���仯���������������������е�Ӧ�÷dz��㷺������̼�������ֻ��һ�����룬����һ��ֵ���ڴ������ʽ��
̼���仯���������������������е�Ӧ�÷dz��㷺������̼�������ֻ��һ�����룬����һ��ֵ���ڴ������ʽ��



