
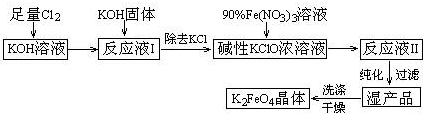
分析 氢氧化钾溶液中充入足量氯气,在温度较低的条件下反应生成氯化钾、次氯酸钾和水,加入氢氧化钾固体除去KCl,得到碱性KClO的浓溶液,加入90%硝酸铁溶液发生反应生成高铁酸钾溶液Ⅱ纯化得到湿产品,洗涤干燥得到K2FeO4晶体;
(1)温度较高KOH与Cl2 反应生成的是KClO3;
(2)根据化合价升降法配平化学方程式,铁元素从+3价升到+6价,氯元素从+1价降到-1价,根据化合价升降法及元素守恒可知反应方程式为:2Fe(NO3)3+3KClO+10KOH→2K2FeO4+6KNO3+3KCl+5H2O,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,氯元素从+1价降到-1价,结合方程式判断;
(3)根据元素守恒和电子得失守恒可写出K2FeO4在弱碱性条件下与水反应生成Fe(OH)3和O2的化学方程式;
(4)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(5)K2FeO4在低温、强碱性溶液中比较稳定;
(6)从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl;
(7)用碱性的碘化钾溶液溶解高铁酸钾样品,调节pH为1,高铁酸根与碘离子发生氧化还原反应,高铁酸根离子全部被还原成铁离子,碘离子被氧化成碘,根据电子得失守恒有关系2FeO42-~3I2,再根据反应2Na2S2O3+I2═Na2S4O6+2NaI,利用硫代硫酸钠的物质的量可计算得高铁酸钾的质量,进而确定质量分数.
解答 解:(1)温度较高KOH与Cl2 反应生成的是KClO3,在低温下KOH与Cl2 反应生成的是KClO.故选择低温较低,故答案为:较低;
(2)根据化合价升降法配平化学方程式,铁元素从+3价升到+6价,氯元素从+1价降到-1价,根据化合价升降法及元素守恒可知反应方程式为:2Fe(NO3)3+3KClO+10KOH→2K2FeO4+6KNO3+3KCl+5H2O,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,氯元素从+1价降到-1价,氧化剂与还原剂的物质的量之比为3:2,故答案为:3:2;
(3)K2FeO4在弱碱性条件下与水反应生成Fe(OH)3和O2的化学方程式为4K2FeO4+10H2O=8KOH+4Fe(OH)3↓+3O2↑,
故答案为:4K2FeO4+10H2O=8KOH+4Fe(OH)3↓+3O2↑;
(4)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A.由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故A正确;
B.与过量的Cl2继续反应,生成更多的KClO,故B正确;
C.由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故C错误;
D.由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故答案为:AB;
(5)K2FeO4在低温、强碱性溶液中比较稳定,减少K2FeO4在过量Fe3+作用下的分解,故答案为:减少K2FeO4在过量Fe3+作用下的分解(或K2FeO4在低温、强碱性溶液中比较稳定等);
(6)从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl,故答案为:KNO3、KCl;
(7)用碱性的碘化钾溶液溶解高铁酸钾样品,调节pH为1,高铁酸根与碘离子发生氧化还原反应,高铁酸根离子全部被还原成铁离子,碘离子被氧化成碘,根据电子得失守恒有关系2FeO42-~3I2,再根据反应2Na2S2O3+I2═Na2S4O6+2NaI,得关系式2FeO42-~3I2~6Na2S2O3,所以高铁酸钾的质量为$\frac{1}{3}$×1.0mol/L×0.015L×198g/mol=0.99g,则原高铁酸钾样品中高铁酸钾的质量分数为$\frac{0.99g}{3.96g}$×100%=25%,
故答案为:25%.
点评 本题考查了物质制备与物质分离提纯的分析判断,实验过程的理解应用和基本操作的分析应用,掌握基础是关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 单质的活泼性:a>c>d | ||
| C. | 原子半径:c>a>d | D. | 最高价含氧酸的酸性:d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01molFeCl3与沸水反应,形成Fe(OH)3胶粒数目小于0.01NA | |
| B. | 常温下,27g铝片加入足量浓硝酸中,转移的电子数目为3NA | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com