
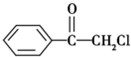
 (1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)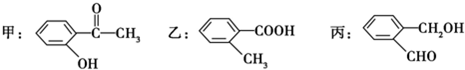
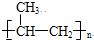 ;
; ;
; .
. 分析 (1)根据有机物官能团的性质推断有机物可能具有的性质;
(2)根据有机物的结构简式可判断含氧官能团;结合同分异构体的定义判断;有机物中-COOH酸性大于酚羟基,醇羟基和醛基都不具有酸性;
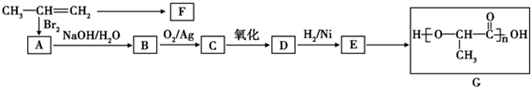
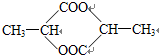
(3)CH3CH=CH2与溴发生加成生成A为CH3CHBrCH2Br,水解生成B为CH3CHOHCH2OH,在催化剂条件下被氧化生成C为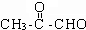 ,则D为
,则D为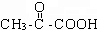 ,E为CH3CHOHCOOH,CH3CH=CH2可发生加聚反应,生成F为
,E为CH3CHOHCOOH,CH3CH=CH2可发生加聚反应,生成F为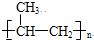 ,以此解答该题.
,以此解答该题.
解答 解:(1)苯氯乙酮含有羰基,可发生加成反应,含有-Cl,可发生取代、水解反应,不能发生消去和银镜反应,
故答案为:ABD;
(2)①丙中含有醛基、羟基等官能团,故答案为:醛基、羟基;
②甲、乙、丙三种物质的分子式相同,但结构不同,属于同分异构体,故答案为:甲、乙、丙;
③有机物中-COOH酸性大于酚羟基,醇羟基和醛基都不具有酸性,则酸性顺序为乙>甲>丙,
故答案为:乙>甲>丙;
(3)CH3CH=CH2与溴发生加成生成A为CH3CHBrCH2Br,水解生成B为CH3CHOHCH2OH,在催化剂条件下被氧化生成C为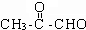 ,则D为
,则D为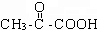 ,E为CH3CHOHCOOH,CH3CH=CH2可发生加聚反应,生成F为
,E为CH3CHOHCOOH,CH3CH=CH2可发生加聚反应,生成F为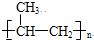 ,
,
①CH3CH=CH2分子中,碳碳双键上所有原子都共面,单键可以旋转,所以丙烯中最多有 7个原子在同一个平面上,
故答案为:7;
②由以上分析可知F为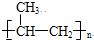 ,故答案为:
,故答案为: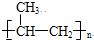 ;
;
③B为CH3CHOHCH2OH,在催化剂条件下被氧化生成C为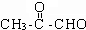 ,反应的方程式为
,反应的方程式为 ,
,
故答案为: ;
;
④E为CH3CHOHCOOH,含有-COOH和-OH,两分子E能脱去两分子水形成一种六元环状化合物,为酯化反应,生成物为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,题目难度中等,本题注意把握有机物的结构和性质,注意同分异构体的判断,易错点为(3),注意以丙烯的性质结合反应条件进行推断,把握官能团的性质为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 在金属元素和非金属元素分界线,可以找到半导体材料 | |
| C. | 元素周期表有十六个族,也就有十六个纵行 | |
| D. | 元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 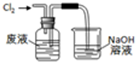 氧化废液中的溴化氢 | B. |  分离CCl4层和水层 | ||
| C. | 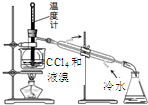 分离四氯化碳和液溴 | D. |  储存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
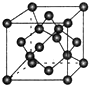 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
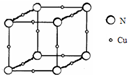 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com