
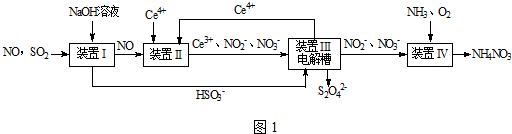
分析 SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,
(1)二氧化硫是酸性氧化物,能和强碱之间发生反应;
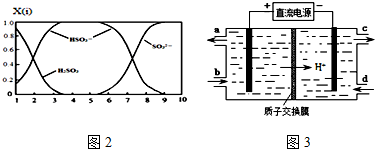
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;
②NaHSO3溶液中HSO3-的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;
(5)电解CuSO4溶液,先在A上收集到5.6L即0.25mol气体,即为氧气,发生反应:4OH--4e-=2H2O+O2↑;A是阳极,B极上发生反应:Cu2++2e-=Cu,该电极析出金属铜,B是阴极,根据电子守恒计算生成金属铜的物质的量,然后电极反接,在B极上收集到5.6L气体即为氧气,此时B是阳极,先是金属铜失电子,然后是4OH--4e-=2H2O+O2↑,根据电子守恒计算即可.
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,故答案为:SO2+OH-=HSO3-;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(4)①在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,故答案为:a;
②电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+4H++4e-=S2O32-+3H2O,故答案为:2HSO3-+4H++4e-=S2O32-+3H2O;
(5)电解CuSO4溶液,先在A上收集到5.6L即0.25mol气体,即为氧气,发生反应:4OH--4e-=2H2O+O2↑;此时转移电子1mol,A是阳极,B极上发生反应:Cu2++2e-=Cu,该电极析出金属铜,B是阴极,根据电子守恒,转移1mol电子,生成金属铜的物质的量是0.5mol,然后电极反接,在B极上收集到5.6L气体即为氧气,此时B是阳极,先是金属铜失电子,发生反应:Cu-2e-=Cu2+,转移电子1mol,然后是4OH--4e-=2H2O+O2↑,收集到5.6L0.25mol气体转移电子1mol,所以转移电子是2mol,
故答案为:2.
点评 本题考查了电解原理、二氧化硫的污染及治理、化学平衡及其影响、氧化还原反应等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用基础知识的能力,注意掌握电解原理、化学平衡移动原理及其应用,能够正确书写电极反应式、离子方程式.


科目:高中化学 来源: 题型:选择题
| A. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) | |
| B. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10mL0.2mol/LNH4NO3溶液与10mL0.1mol/LNaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>(NH3•H2O)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| C. | 室温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.7×10-5,则CH3COOH溶液中c(H+)和NH3•H2O溶液中的c(OH-)相等 | |
| D. | 室温下,向0.10mol•L-1的氨水中加入少量NaOH,溶液中c(NH${\;}_{4}^{+}$)减小,Kw减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的3/8 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液与Na2S溶液混合 | B. | 将H2S气体通入Al2(SO4)3溶液中 | ||
| C. | 将Al(NO3)3固体与K2S固体混合 | D. | 将金属铝与硫混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com