
| [H+] |
| C(HA) |
| [H+][A-] |
| [HA] |
| 10-4×10-4 |
| 0.1-10-4 |


科目:高中化学 来源: 题型:
 化学反应可视为旧键断裂和新键形成的过程.已知断开1mol下列化学键时需要吸收的能量分别为:P-P 198kJ、P-O 360kJ、O=O 498kJ
化学反应可视为旧键断裂和新键形成的过程.已知断开1mol下列化学键时需要吸收的能量分别为:P-P 198kJ、P-O 360kJ、O=O 498kJ查看答案和解析>>
科目:高中化学 来源:2015届山东省高一暑假作业(四)化学试卷(解析版) 题型:实验题
如图所示,把试管放入盛有25 ℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,试回答下列问题:
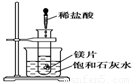
Ⅰ.(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________
(2)产生上述现象的原因是
________________________________________________________________________
________________________________________________________________________
(3)写出有关反应的离子方程式
________________________________________________________________________
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.已知断开1mol H—H键,1mol N—H键、1 molNN键分别需要吸收的能量为436kJ、391kJ、946kJ。一定条件下由氢气和氮气反应生成1mol NH3需要________(填“放出”或“吸收”)________kJ的热量。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省盘锦二中高三(上)第二次段考化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com