
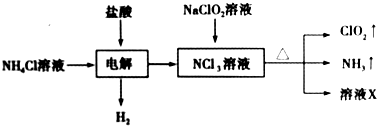
| A. | 电解时发生反应的离子方程式为NH4++3Cl-$\frac{\underline{\;电解\;}}{\;}$2H2↑+NCl3 | |
| B. | 溶液X中大量存在的阴离子有Cl-、OH- | |
| C. | 可用饱和食盐水除去ClO2中的NH3 | |
| D. | 可用明矾除去饮用水中残留的NaClO2 |
分析 氯化铵溶液中加入盐酸通电电解,得到NCl3溶液氮元素化合价-3价变化为+3价,在阳极发生氧化反应,阴极是氢离子得到电子发生还原反应生成氢气,在NCl3溶液中加入NaClO2溶液加热反应生成ClO2、NH3和溶液X,NCl3与NaClO2按一定物质的量之比混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH.
解答 解:A.NH4Cl溶液中加入盐酸进行电解得到NCl3,NCl3溶液氮元素化合价-3价变化为+3价,在阳极发生氧化反应,阴极是氢离子得到电子发生还原反应生成氢气,反应的化学方程式为:NH4++2H++3Cl-$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,故A错误;
B.上述分析可知NCl3与NaClO2按一定物质的量之比混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电子守恒和电荷守恒可知,反应还生成NaCl与NaOH,溶液X中大量存在的阴离子有Cl-、OH-,故B正确;
C.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,不可用饱和食盐水除去ClO2中的NH3,故C错误;
D.明矾净水的原理是利用铝离子水解生成氢氧化铝胶体的吸附性,吸附悬浮杂质,不能吸收除去饮用水中残留的NaClO2,故D错误;
故选B.
点评 本题考查了物质性质、电解原理、盐类水解、氧化还原反应电子守恒等知识点的分析应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(HCN)>c(CN-) | B. | c(Na+)<c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于7.1g | B. | 小于7.1g | ||
| C. | 大于7.1g,小于14.2g | D. | 大于14.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | HOOC-COOH | C. | HO(CH2)2CHO | D. | HO- -COOH -COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

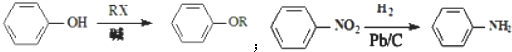

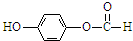 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | C | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH=a |
| 丙 | 0.2 | 0.2 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com