
【题目】环己醇(![]() )常用来制取增塑剂和作为工业溶剂。下列说法正确的是( )
)常用来制取增塑剂和作为工业溶剂。下列说法正确的是( )
A. 环己醇中至少有12个原子共平面
B. 与环己醇互为同分异构体,且含有醛基(—CHO)的结构有8种(不含立体结构)
C. 标准状况下,1mol环己醇与足量Na反应生成22.4LH2
D. 环己醇的一氯代物有3种(不含立体结构)
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位罝如图,其中只有M为金属元素。下列说法不正确的是( )
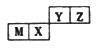
A. 原子半径Z
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不可能存在的有机物是 ( )
A. 2—甲基丙烷
B. 2,3—二氯—2,2—二甲基戊烷
C. 3—溴—3—乙基戊烷
D. 2,2,3,3—四甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知乙醇与浓硫酸混合加热可发生如下反应:CH3CH2OH→CH2-CH2↑+H2O,可看作乙醇分子中脱去一分子水而生成乙烯。
(1)lmol组成为C3H8O的液态有机物A,与足量钠反应生成11.2LH2(标准状况),则A中必有一个_____基,若此基连在碳链的一端,则A的结构简式为_____________。
(2)A与浓硫酸共热也可分子内脱去一分子水而生成B,写出反应的化学方程________________。
(3)B通入溴水中可发生__________反应,该反应的方程式为:___________________。
(4)A在铜丝催化下,加热时与O2反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源.将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是

A. b为铅蓄电池的正极 B. 电解过程中,阳极区溶液中c(H+)逐渐减小
C. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O D. 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见化合物。下列说法正确的是( )
A. 原子半径:Z>Y>X>W>Q
B. Q、X形成的化合物的电子式为![]()
C. 最简单氢化物的稳定性:Z>W
D. 工业上常用电解的方法制备X、Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 密度:CCl4>CHCl3>H2O>苯
B. 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
C. 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷
D. 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在己经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种但与生产生活有密切的联
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_________________。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①合成氨的反应中的能量变化如图所示.该反应是__________反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量__________(填“大于”或“小于”)生成物化学键形成放出的总能量。
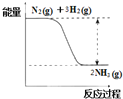
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)键性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是_________,放电时,外电路中每通过0.2mol电子,锌的质量理论上减小______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com