
【题目】下列叙述中正确的是 ( )
A. 氢氧化铁胶体是一种红褐色沉淀
B. 氢氧化亚铁能与盐酸反应生成氯化铁和水
C. 氢氧化亚铁在空气中放置可转化为氢氧化铁
D. 氢氧化亚铁在空气中加热可分解生成氧化亚铁和水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将装有16mL一氧化氮的试管倒置在水槽中,向试管中缓缓通入氧气,使试管中液面稳定在试管容积的一半,则通入氧气的体积可能为
A. 6mL B. 8mL C. 10mL D. 12mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. CaCO3的电离方程式:CaCO3 ![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。
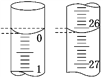
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 合成硫酸的工业尾气可以直接排入大气
B. 进入接触室的气体,必须先经净化、干燥
C. 从沸腾炉中排出的炉渣可以作为肥料
D. 在高温、高压下由SO2和O2合成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示中物质转化最终生成乙酸和高分子涂料胶黏剂Y的合成路线如下(部分反应条件已省略):

(1)化合物CH2═CHCOOH中所含官能团名称为_____________和____________;
(2)正丁烷的一种同分异构体的结构简式为_____________;Y的结构简式为_____________;
(3)图中8步反应中,原子利用率没有达到100%的为_____________(填序号)。
(4)写出下列反应的化学方程式(注明反应条件):反应⑥__________________________;反应⑧为(同时有水生成)_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的结构、性质的叙述正确的是( )
A. 苯、油脂均不能使酸性KMnO4溶液褪色
B. 甲烷和C12的反应与乙烯和Br2的反应属于同一类型的反应
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g)![]() PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
A. 10 min内,v(Cl2) = 0.04 mol/(L·min)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的![]()
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com