
(16分)工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
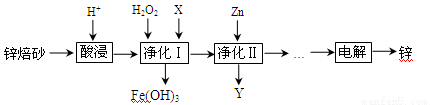
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
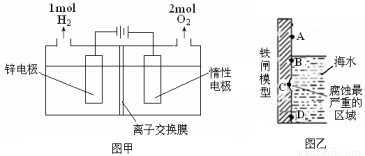
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
(1)增大硫酸的浓度(2分,合理即给分)(或升高温度,或减小锌焙砂颗粒大小,或空气搅拌等)
ZnFe2O4+8H+=Zn2+ +2Fe3+ +4H2O(2分) (2)H2O2+2Fe2++2H+═2Fe3++2H2O(2分) ZnO(2分,合 理即给分) Cu(1分)(3)c(2分) 75%(2分)(4)[Zn(OH)4]2-+2e-=Zn+4OH-(2分) C(1分)
【解析】
试题分析:(1)提高酸浸效率就是加快反应速率,措施有增大硫酸的浓度、升高温度、减小锌焙砂颗粒大小等。H+与难溶固体ZnFe2O4反应的离子方程式为:ZnFe2O4+8H+=Zn2+ +2Fe3+ +4H2O。(2)由于有FeO、CuO等氧化物杂质,所以酸浸后溶液中有Fe2+、 Cu2+,根据流程铁以Fe(OH)3的形式沉淀,故Fe2+要被氧化,H2O2做氧化剂,反应的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O,溶液显酸性Fe3+不能转变为Fe(OH)3,故加入X来调节溶液的酸碱性,为了不引入新的杂质最好加入ZnO或Zn(OH)2,净化Ⅰ后溶液中还有Cu2+杂质,加入Zn可以置换出Cu,故Y是Cu。(3)根据产生的H2、O2知道是溶液中的H+、OH-先放电,根据离子的放电顺序知道电解质溶液应该为ZnSO4溶液 ;根据4OH——4e—═ O2 ↑+ 2H2O,生成2mol的O2失去的电子为8mol,又根据:2H+ + 2e—═H2 ↑ ,生成1mol的H2 得到的电子为2mol,实际用于生成Zn的电子为8-2=6mol,故利用率为75% 。(4)用[Zn(OH)4]2-的强碱性电镀液进行镀锌,知道Zn元素由+2价变为0价,发生还原反应,故在阴极上反应,电极反应为:[Zn(OH)4]2-+2e-=Zn+4OH-,用Zn来保护铁,根据图示,安装在铁腐蚀最严重的地方效果最好,所以安在C区。
考点:化工流程题的额解题思维、离子方程式的书写、电解池的工作原理、电极反应的书写和金属的防护。
考点分析: 考点1:离子方程式 考点2:电解池 考点3:物质的制备 试题属性

科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:实验题
(15分)3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析。
(1)甲用湿润的KI-淀粉试纸检验上述生成的气体,观察到试纸变蓝,据此判断氧气中混有Cl2。用离子方程式解释甲判断试纸变蓝的原因 。
(2)乙认为上述现象只能说明混合气体具有 性,实验中使试纸变蓝的气体单质还可能是 。为了进一步验证甲的推测,乙补充了一个实验:将上述生成的气体冷却后通入盛有 溶液的洗气瓶中,若现象为 ,则甲的推测合理 。
(3)丙查阅文献获知,这种方法制取氧气的过程中确有Cl2产生,并且查到了以下反应历程:
①2KClO3 + 2MnO2 → 2KMnO4 + Cl2 + O2↑
② 反应②
③K2MnO4 + Cl2 → 2KCl + MnO2 + O2↑
总反应 2KClO3→2KCl + 3O2↑
丙设计实验,通过观察MnO4-的特征颜色来验证反应历程中①的发生,具体实验操作为:将一定量的KClO3 和MnO2混合于试管中,加热, 。写出历程中反应②的化学方程式 。
(4)另据文献记载:此法制取的氧气中除了含有Cl2,还混有化合物ClO2。ClO2具有强氧化性,可以将污水中的S2-氧化成SO42-,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.人造纤维、合成纤维和光导纤维都是有机高分子化合物
B.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
C.明矾用于净水既与盐类的水解有关,又与胶体的眭质有关
D.棉花、羊毛及台成纤维完全燃烧都只生成二氧化碳和水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列说法正确的是
A.铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等
B.如果发生氯气泄漏,附近人员应迅速远离液氯泄漏地点,并顺风往低洼区域疏散
C.“低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放
D.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:实验题
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:

回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是________。
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。

(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:选择题
高功率LaNi5H6 (氢的化合价为0价)电池已经用于混合动力汽车。总反应如下:LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2
LaNi5+6Ni(OH)2
下列叙述正确的是
A.充电时储氢合金作阳极
B.放电时每转移6mol电子,有6moLNiO(OH)被氧化
C.充电时阳极周围pH增大
D.放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:填空题
选考[化学—选修物质结构与性质](15分)
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)A、C单质熔点A_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______;
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______;
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。该晶体中阳离子和阴离子个数比为___,晶体中每个Xn-被__个等距离的C+离子包围。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com