
【题目】(10分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.
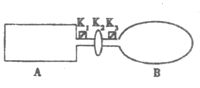
关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)![]() N2O4(g) △H<0。
N2O4(g) △H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不 变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将 。
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率(写出计算过程)
【答案】(10分)(1)< 变小(2)增大 不变 变小(3)A (4)40%
【解析】(1)A容器相当于恒温恒容,B容器相当于恒温恒压;而2NO2(g)![]() N2O4(g) △H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
N2O4(g) △H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将增大,因加入NO2浓度增大平衡将向正反应方向移动,且由于加入NO2使容器内压强增大,从而使平衡向正反应方向移动,故当达到平衡时,NO2的转化率α(A)将增大;若通入等量的Ne气,则达到平衡时,A中NO2的转化率不变,因为从表面上看,A容器内压强增大了,但容器内各组成的浓度没度,平衡不移动,转化率即也不变;B容器为保持压强不变,体积必然会增大,导致体系内各组分的浓度降低,平衡会向逆反应方向移动,转化率将变小。
B容器的现象可看成是在A容器的基础上降温,平衡将向正反应方向移动,即B容器内NO2气体的浓度将比A容器内NO2气体的浓度低,颜色将更浅。
在相同条件下,体系内压强之比=物质的量之比,4.6g的NO2的物质的量为0.2mol;
2NO2(g)![]() N2O4(g) △H<0
N2O4(g) △H<0
0.2mol 0
2x x
0.2mol-2x x
得:(0.2mol-2x+x)/0.2mol
得: x=0.04mol
所以NO2的转化率为:(2x0.04mol)/0.2mol=40%


科目:高中化学 来源: 题型:
【题目】下列事实可以用同一原理解释的是( )
A.氯气和二氧化硫均可使品红褪色
B.乙烯可使溴水或酸性高锰酸钾溶液褪色
C. ClO2和漂白粉现在都常用于自来水的处理
D.苯酚和氢氧化钠溶液在空气中久置均会变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。求
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。求
①10min内用氢气表示的平均反应速率_____________
②10min后达到平衡时CO的浓度_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙醇分子中含有一个羟基的事实是( )
A. 1mol乙醇完全燃烧生成3mol水
B. 乙醇能与水以任意比例互溶
C. 乙醇沸点较高
D. 0.1mol乙醇与足量金属钠反应生成0.05molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)为探究黑色固体X(仅含两种元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X的化学式是________。
(2)固体甲与稀硫酸反应的离子方程式是___________。
(3)加热条件下氨气被固体X氧化成一种气体单质,写出该反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO2+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃

请回答:
⑴仪器A的作用是_____;冰水浴冷却的目的是_____(写出两种)。
⑵空气流速过快或过慢,均降低NaClO2产率,试解释其原因______。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_____(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是______,馏出物是_______。

(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在呈酸性的无色溶滚中大量共存的是( )
A. Ba2+、Na+、NO3-、SO42- B. Mg2+、Cl-、Al3+、SO42-
C. K+\、OH-、HCO3-、NO3- D. NH4+、Na+、Fe2+、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO
②单位时间内生成n molO2的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com