
工业合成氨N2 + 3H2![]() 2NH3,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是
2NH3,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是
A.该反应使用铁触媒作催化剂,目的是为了增大反应速率,同时提高产率
B.升高温度可以增大正反应速率,同时减小逆反应速率
C.达到平衡时,N2、H2、NH3的浓度之比为1∶3∶2
D.为了提高H2的转化率,可适当提高N2的浓度
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
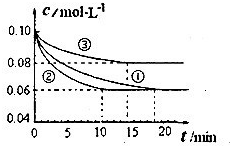 (2013?烟台一模)氮及其化合物在工农业生产中具有重要作用.
(2013?烟台一模)氮及其化合物在工农业生产中具有重要作用.| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏无锡市洛社高级中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(9分)氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2 ﹑t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t2 t4 t5 t7 。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏无锡市高二下学期期中考试化学试卷(解析版) 题型:填空题
(9分)氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)
 2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2 ﹑t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t2 t4 t5 t7 。

②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A
c(I2)B ;平衡时HI的分解率αA
αB ;平衡时H2在混合气体中的体积分数A
B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A
c(I2)B ;平衡时HI的分解率αA
αB ;平衡时H2在混合气体中的体积分数A
B (填写“>”“<”“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com