
分析 (1)需用480mL 0.2mol/L的硫酸铜溶液,而容量瓶中没有480mL容量瓶,需要选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(2)容量瓶,使用容量瓶前应检查是否漏水;
(3)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①③④②⑤;
(4)上述操作⑤中,如果不小心加水超过刻度线,只能重新配置;
(5)分析操作对溶质的物质的量n和溶液体积V的影响,依据C=n/V,凡是使n偏大或者使V偏小的操作都会使溶液浓度偏高,反正使溶液浓度偏低,据此解答.
解答 (1)需用480mL 0.2mol/L的硫酸铜溶液,而容量瓶中没有480mL容量瓶,需要选择500mL容量瓶,实际配制500mL溶液,需称胆矾的质量m=CVM=0.2mol/L×0.5L×250g/mol=25.0g,
故答案为:25.0g;
(2)容量瓶,使用容量瓶前应检查是否漏水,
故答案为:检查是否漏水;
(3)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①③④②⑤,
故答案为:①③④②⑤;
(4)上述操作⑤中,如果不小心加水超过刻度线,只能重新配置,
故答案为:重新配置;
(5)分析操作对溶质的物质的量n和溶液体积V的影响,依据C=n/V,凡是使n偏大或者使V偏小的操作都会使溶液浓度偏高,反正使溶液浓度偏低,据此解答:①在烧杯中搅拌溶液时,有少量液体溅出,导致部分溶质损坏,溶质的物质的量偏小,溶液浓度偏低,
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,
③容量瓶洗净后残留少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,
④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过,导致溶质的物质的量偏大,溶液浓度偏高,
⑤定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,
所以导致所配硫酸铜溶液物质的量浓度偏低的是:①②⑤,
故答案为:①②⑤.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意依据C=n/V进行误差分析的方法,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液可盛放在碱式滴定管中 | |
| B. | 可用酚酞或甲基橙作滴定的指示剂 | |
| C. | 若滴定管未用待测KMnO4溶液润洗,则会使测得的KMnO4溶液浓度偏小 | |
| D. | 滴定过程中褪色速率先慢后快,是由于锥形瓶中KMnO4溶液浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA
B.常温常压下,18 g H2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.1 L 0.1 mol/L NaOH溶液含有阴阳离子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列名词中,哪个名词不属于物理量
A.长度 B.气体摩尔体积 C.摩尔 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大 | |
| B. | 电离平衡常数(K)与温度无关 | |
| C. | 不同浓度的同一弱电解质,其电离平衡常数(K)不同 | |
| D. | 多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加CH3COONa固体促进醋酸的电离 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
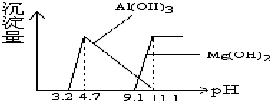 根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:| A. | Al(OH)3 和Mg(OH)2在水溶液中的电离过程完全相同 | |
| B. | 若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 | |
| C. | 当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) | |
| D. | 等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com