
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )

A. C元素是非金属性最强的元素
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. 三种元素的原子半径的大小顺序是:B>C>A
【答案】D
【解析】
这几种元素都是短周期元素,A和C属于第二周期元素、B属于第三周期元素,设B原子序数是x,则A的原子序数是x-9、C原子序数是x-7,A、B、C三种元素原子核外电子数之和等于B原子的质量数,B原子核内质子数和中子数相等,则x-9+x+x-7=2x,x=16,所以B是S元素,则A是N元素、C是F元素,据此答题。
A.在周期表中非金属性最强的元素位于周期表右上角(稀有气体除外),所以非金属性最强的元素是F元素,故A正确;
B.氮元素的最高价氧化物的水化物是硝酸,硝酸具有强氧化性,能氧化较不活泼的金属、非金属,如C、Cu等,故B正确;
C.B元素氧化物的水化物有H2SO3、H2SO4,氢化物是H2S,这三种物质都是二元酸,其水溶液都呈酸性,故C正确;
D.B原子电子层数大于A、C,A和C电子层数相等,且A原子序数小于C,所以原子半径大小顺序是B>A>C,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)稀酸A的分子式是_____________________________________________。
(2)滤液1中加入H2O2溶液的目的是___________________________________________。
(3)设计实验证明滤液1中含有Fe2+___________________________________________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是__________________________________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.Ca(OH)2=Ca2++2(OH-)B.FeCl3=Fe2++3Cl-
C.H2SO4=H++SO42-D.Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大![]() 是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体
是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体![]() 请回答下列问题:
请回答下列问题:
(1)![]() 在元素周期表中的位置为______.
在元素周期表中的位置为______.
(2)![]() 、Q、M简单离子半径由大到小的顺序为
、Q、M简单离子半径由大到小的顺序为![]() 写元素离子符号
写元素离子符号![]() ______.
______.
(3)![]() 、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:
、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:![]() 用离子方程式表示
用离子方程式表示![]() ______
______![]() 溶液中所含离子浓度由大到小的顺序为______.
溶液中所含离子浓度由大到小的顺序为______.
(4)![]() 的电子式为______,
的电子式为______,![]() 与水可剧烈反应,产生沉淀与气体,反应的化学方程式为______.
与水可剧烈反应,产生沉淀与气体,反应的化学方程式为______.
(5)![]() 、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为______.
、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为______.
(6)![]() 的单质与R的最高价氧化物对应的水化物反应的离子方程式为______.
的单质与R的最高价氧化物对应的水化物反应的离子方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。
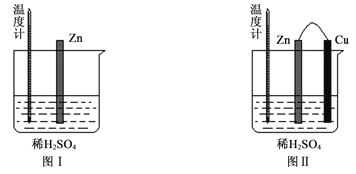
A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示。下列说法不正确的是( )

A. HA为弱酸,BOH为弱碱
B. b点时,c(B+) = c(A-)
C. c点时,混合溶液呈碱性的主要原因是过量的BOH电离出OH-,使得溶液中c(OH-) > c(H+)
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com