
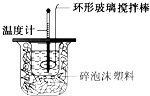
 某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液
某实验小组用0.50mol?L-1 NaOH溶液和0.55mol?L-1盐酸溶液进行中和热的测定.Ⅰ.配制0.50mol?L-1 NaOH溶液| 1.4212KJ |
| 0.025mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由CH2=CHCOOCH3合成的聚合物为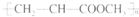 |
| B、溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| C、装饰材料中的甲醛和芳香烃会造成居室污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
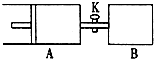 如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )
如图,容器A左侧是可平行移动的活塞.关闭活塞K,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时A、B的体积都等于aL.在温度相同、外界压强相同和催化剂存在的条件下,使两容器各自发生反应:X(g)+Y(g)?Z(g)+2W(g).达平衡时,A的体积为1.2aL.下列说法正确的是( )| A、反应速率:V(B)<V(A) |
| B、A容器中X转化率为20% |
| C、平衡时的压强:P(B)=2P(A) |
| D、若打开K,则达到新的化学平衡时,A的体积为2.6aL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com