
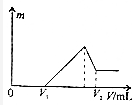
 将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )| A. | 1:1 | B. | 2:3 | C. | 16:27 | D. | 8:9 |
分析 0~V1段滴入氢氧化钠溶液后没有生成沉淀,说明硫酸过量,加入的氢氧化钠与剩余的硫酸反应生成硫酸钠和水;最高点时沉淀达到最大量,说明铝离子、镁离子完全转化成氢氧化铝、氢氧化镁沉淀;最后氢氧化铝溶解,此时沉淀只有氢氧化镁,V2=460mL时,溶液的组成是NaAlO2和Na2SO4混合液,根据钠元素守恒以及硫酸根离子量的关系来计算即可.
解答 解:当V2=460mL时,溶液的组成是NaAlO2和Na2SO4混合液,在硫酸钠中,n(SO42-)=0.5n(Na+)=0.2mol,所以硫酸钠中钠离子物质的量是0.4mol,根据钠守恒,所以n(NaAlO2)=n(Al)=0.46L×1mol/L-0.4mol=0.06mol,所以镁的物质的量是0.04mol,原混合物中镁铝的质量比是$\frac{0.04×24}{0.06×27}$=$\frac{16}{27}$,故选C.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,使计算简化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅和氢氧化钠溶液反应 | B. | 二氧化碳通入饱和Na2CO3溶液 | ||
| C. | 镁在二氧化碳中燃烧 | D. | 氯气通入到氯化亚铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者互为同系物 | |
| B. | 聚乙烯是乙烯的缩聚产物 | |
| C. | 二者都能使溴的四氯化碳溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯分别完全燃烧消耗等物质的量的氧气,生成等量的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ( y≠0 ).请回答:
( y≠0 ).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
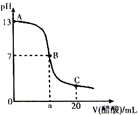 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 的名称是1,3-二甲基苯
的名称是1,3-二甲基苯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 |  | 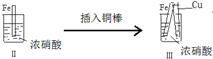 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com