
下列有关实验原理或实验操作的叙述正确的是 ( )。
 [
[
A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上
称量
B.欲除去NO中少量的NO2,将混合气体通入足量NaOH溶液
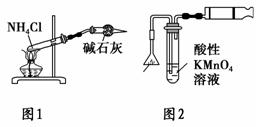
C.实验室用图1所示装置制取少量氨气
D.实验室用图2所示装置检验火柴头燃烧 产生的SO2
产生的SO2
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且溶液为无色透明的离子组是 ( )
A.K+ 、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42- D.Fe3+、Na+、Cl-、SO421-
查看答案和解析>>
科目:高中化学 来源: 题型:
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) 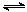 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |

下列说法正确的是
A.x=1 B.Q1>2Q2 C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.向醋酸钠溶液中加水稀释时,溶液中所有离子浓度都减小
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小
2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥
至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是: ▲ 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1
可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ ▲ mol·L−1。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组的同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
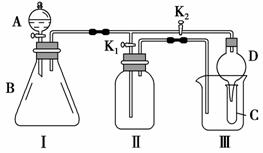
(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1,关闭K2,可 制取 ________气体。
制取 ________气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是________________;打开K2,关闭K1,将A中液体加入B中后,观察到的实验现象为___________________________________________________
________________________________________________________ _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数:( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.amol·L—1HCN溶液与amol·L—1NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+),c(Na+)>c(CN-)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO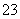 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA
B.1mol/LFeCl3 溶液中所含Fe3+的数目小于NA
C.常温下,1L pH=12的Ba(OH)2 溶液中含OH—的数目为2NA
D.23g NO2和N2O4的混合气体中含有氮原子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com