
| A. | 120mL | B. | 150mL | C. | 200mL | D. | 220mL |
分析 再逐滴加入1mol/L NaOH溶液,若滴加NaOH溶液体积至80mL时,溶液中始终未产生沉淀,然后继续滴加NaOH溶液则开始出现沉淀,说明硫酸有剩余,据此可计算出金属消耗硫酸的物质的量,然后列式计算出镁、铝的物质的量;当沉淀的质量不再变化时,溶质为偏铝酸钠和硫酸钠,结合质量守恒定律计算出消耗氧化钠的物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:“若滴加NaOH溶液体积至80mL时,溶液中始终未产生沉淀,然后继续滴加NaOH溶液则开始出现沉淀”,说明硫酸有剩余,
80mL 1mol/L的氢氧化钠溶液中含有氧化钠的物质的量为:1mol/L×0.08L=0.08mol,0.08mol氧化钠消耗硫酸的物质的量为:0.08mol×$\frac{1}{2}$=0.04mol,
则0.05mol镁和铝总共消耗硫酸的物质的量为:1mol/L×0.1L-0.04mol=0.06mol,
设混合物中含有Mg、铝的物质的量分别为x、y,
则:x+y=0.05、x+1.5y=0.06,解得:x=0.03mol、y=0.02mol,
当溶液中沉淀质量不再发生变化时,此时溶质为偏铝酸钠和硫酸钠,根据质量守恒定律可知:n(Na2SO4)=n(H2SO4)、n(NaAlO2)=n(Al),
故n(NaOH)=2n(Na2SO4)+n(NaAlO2)=n(Al)+2n(H2SO4)=2×0.1L×1mol/L+0.02mol=0.22mol,
所以需要氢氧化钠溶液的体积为:$\frac{0.22mol}{1mol/L}$=0.22L=220mL,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g NH3所含的电子数是 10NA | |
| B. | 常温常压下,22.4L氧气含氧原子数为2NA | |
| C. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| D. | 2.3g金属钠全部变成钠离子时失去的电子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下NaHCO3比Na2CO3更 稳定 | |
| B. | 向等量的Na2CO3和NaHCO3固体中分别滴加同浓度的盐酸,后者产生气泡速率快 | |
| C. | 相同条件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 经实验测定,Na2CO3溶液显碱性,说明Na2CO3属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 用氯化铁溶液腐蚀铜板:Fe3++Cu═Cu2++Fe2+ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
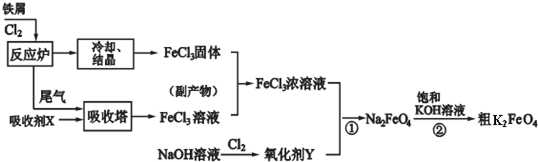
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
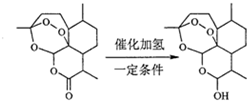
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com