
科目:高中化学 来源: 题型:选择题
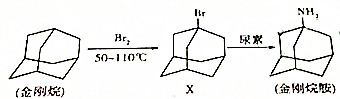
| A. | 金刚烷是不饱和烃 | B. | 金刚烷胺的分子式为C10H16N | ||
| C. | 上述反应都属于取代反应 | D. | X与尿素反应的另-种生成物是H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
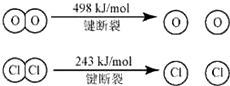
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
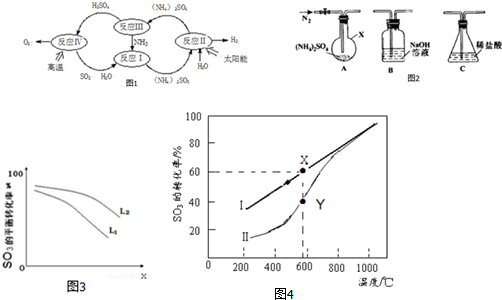
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Al3+ 的氧化性依次减弱 | |
| B. | HI、HBr、HCl 的还原性的依次减弱 | |
| C. | H2S、H2O、HF的热稳定性依次增强 | |
| D. | O2-、F-、Na+、Br-的半径大小顺序为:Br->O2->F->Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
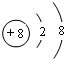 ,C的原子结构示意图为
,C的原子结构示意图为 .
. ,A与D的化合物的电子式为
,A与D的化合物的电子式为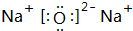 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com