
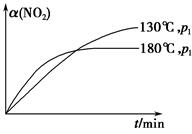
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)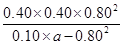 =6.4,解得a=1.2
=6.4,解得a=1.2


科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。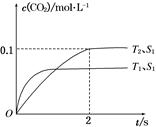

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2H2(g)+O2(g) 2H2O(l) ΔH="-285.8" kJ/mol 2H2O(l) ΔH="-285.8" kJ/mol |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol |
C.CH4(g)+2O2(g) CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.392.93 Kj | B.2 489.42 kJ |
| C.784.92 kJ | D.3 274.3 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
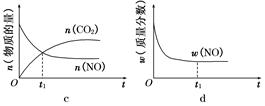
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0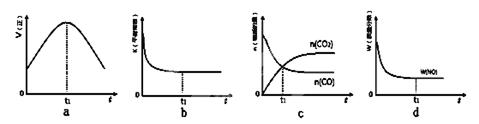
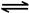 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 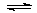 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。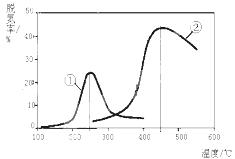
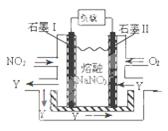
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
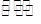 N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1; 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1; 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1; 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com