
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.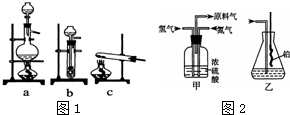
分析 (1)根据反应物的状态与反应条件选择发生装置;
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,据此来回答;
(4)氨的氧化反应是一个放热反应;生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮与水反应生成硝酸,硝酸与氨气反应生成白色固体硝酸铵.
解答 解:(1)制备氨气的反应原理:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H20+NaCl,该反应为溶液加热制备气体,发生装置选择a;
故选:a;
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体;
故答案为:将气体混合均匀、控制氢气和氮气的流速;
(3)合成氨的反应为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,该反应为可逆反应,还会有一些氮气、氢气存在,这样会缓解氨气极易溶于水导致的气压差,不会倒吸,
故答案为:不会;因为混合气体中含有大量难溶于水的氮气、氢气两种气体;
(4)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热,锥形瓶中生成的一氧化氮与空气中的氧气化合成二氧化氮,方程式为:2NO+O2=2NO2,二氧化氮为红棕色气体,二氧化氮与水反应生成硝酸,方程式:3NO2+H2O=2HNO3+NO,硝酸与氨气反应生成白色固体硝酸铵,方程式:NH3+HNO3=NH4NO3;
故答案为:说明氨的氧化反应是一个放热反应;有红棕色气体产生;2NO+O2=2NO2 3NO2+H2O=2HNO3+NO NH3+HNO3=NH4NO3.
点评 本题考查了气体的制备原理和性质,明确氮及其化合物的性质是解题关键,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 平衡时,2v正(NO)=v逆(N2) | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ②④ | B. | ②③④ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 4.0 mol SO2+1.0 mol O2 | |
| C. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol | B. | 4.5mol | C. | 5.5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合的能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外层有7个电子 | D. | 砹易溶于水,难溶于四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com