

 A.如果A是金属元素,则B可能是稀有元素
A.如果A是金属元素,则B可能是稀有元素
 B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
 C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:不详 题型:填空题
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答:
形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答: ,电池总反应的化学方程式为 。
,电池总反应的化学方程式为 。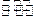 DE2(g) + F2(g) △H<0,达平衡时,有50%
DE2(g) + F2(g) △H<0,达平衡时,有50% 的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是| 时间/min | n(DE)/ mo1 | n(F2E)/mo1 | n(DE2)/ mo1 | n(F2)/ mo1 |
| 0 | 1 | 4 | 0 | 0 |
| 4 | 0.25 | 3.25 | 0.75 | 0.75 |
| 6 | n1 | n2 | n3 | n4 |
| 8 | n1 | n2 | n3 | n4 |
| t | 0.15 | 3.15 | 0.85 | 0.85 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子化合物的熔点一定比共价化合物的熔点高 |
| B.原子序数为13的元素位于元素周期表的第3纵行 |
| C.非金属原子间以共价键结合的物质都是共价化合物 |
| D.短周期元素X、Y的简单离子(X2-、Y+)具有相同电子层结构,则两元素的离子半径X2->Y+,原子半径Y>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.①② | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com