
| A. | CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸 | |
| B. | 四苯基乙烯(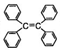 )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| C. | lmol 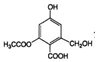 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |
分析 A.含-COOH的主链含4个C,3号C上有羟基;
B.碳碳双键、苯环为平面结构,苯环与双键相连的单键可旋转;
C.-OH、-COOH均与Na反应,-COOH、-COOC-与NaOH反应,只有-COOH与NaHCO3溶液反应;
D.苯与液溴、浓硝酸生成溴苯、硝基苯,均为苯环上H被取代.
解答 解:A.含-COOH的主链含4个C,3号C上有羟基,则名称为3-羟基丁酸,故A正确;
B.碳碳双键、苯环为平面结构,苯环与双键相连的单键可旋转,则四苯基乙烯( )中所有碳原子不一定处于同一平面,故B错误;
)中所有碳原子不一定处于同一平面,故B错误;
C.-OH、-COOH均与Na反应,-COOH、-COOC-与NaOH反应,只有-COOH与NaHCO3溶液反应,则1mol该物质消耗这三种物质的物质的量分别是3mol、4mol、1mol,故C正确;
D.苯与液溴、浓硝酸生成溴苯、硝基苯,均为苯环上H被取代,均为取代反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| B | 区分碳酸钠和碳酸氢钠两种溶液 | 用氢氧化钡溶液分别滴加,观察现象 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F原子结构示意图: | B. | 次氯酸电子式H Cl O | ||
| C. | H、D、T表示同一种核素 | D. | CO2的结构式为O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C、D形成的简单离子半径,前者大于后者 | |
| B. | F的热稳定性比H2S弱 | |
| C. | 化合物A、F中化学键的类型相同 | |
| D. | 元素C、D的最高价氧化物的水化物均可以和H发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3的溶解度高于NaCl | |
| B. | KNO3的溶解度低于NaCl | |
| C. | 含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯 | |
| D. | 含有多种杂质时,NaCl比KNO3更适合利用降温结晶(或重结晶)法进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验操作 | 现象或结论 |
| ① | 测饱和NaHCO3溶液的pH | pH为8.3 |
| ② | 向2mL Na2CO3溶液中加入MgCl2溶液 | 有白色沉淀生成 |
| ③ | 向2mL饱和NaHCO3溶液中加入MgCl2溶液 | 无明显现象 |
| ④ | 向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时 | 溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com