
| A. | 以X浓度变化表示的反应速率为0.0001mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
分析 经60s达到平衡,生成0.3molZ,则
2X(g)+Y(g)?Z(g),
开始 1 1 0
转化 0.6 0.3 0.3
平衡 0.4 0.7 0.3
A.结合v=$\frac{△c}{△t}$计算;
B.将容器体积变为20L,压强减小,平衡逆向移动;
C.增大压强,平衡正向移动;
D.若升高温度,X的体积分数增大,可知升高温度平衡逆向移动.
解答 解:经60s达到平衡,生成0.3molZ,则
2X(g)+Y(g)?Z(g),
开始 1 1 0
转化 0.6 0.3 0.3
平衡 0.4 0.7 0.3
A.X浓度变化表示的反应速率为$\frac{\frac{0.6mol}{10L}}{60s}$=0.001mol/(L•s),故A错误;
B.将容器体积变为20L,压强减小,平衡逆向移动,则Z的平衡浓度小于原来的$\frac{1}{2}$,故B错误;
C.增大压强,平衡正向移动,则物质Y的转化率增大,故C错误;
D.若升高温度,X的体积分数增大,可知升高温度平衡逆向移动,正反应为放热反应,则该反应的△H<0,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握速率计算、化学平衡移动等为解答的关键,侧重分析与计算能力的考查,注意选项B为解答的易错点,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用X表示此反应的反应速率是0.1amol•L-1•min-1 | |
| B. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 | |
| C. | 向平衡后的体系中加入1 mol M,平衡向逆反应方向移动 | |
| D. | 向上述平衡体系中再充入1 mol X,v正增大,v逆减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态阳离子,甲比乙的氧化性强 | |
| C. | 甲能与冷水反应而乙不能 | |
| D. | 将甲、乙组成原电池时,乙为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A 的转化率为70% | |
| D. | 2 s 时物质 B 的浓度为 0.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
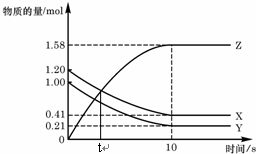 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b}{5×100%}$ | B. | $\frac{2(a+b)}{5b×100%}$ | C. | $\frac{200(a+b)}{5b}$% | D. | $\frac{(a+b)}{5a×100%}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com