
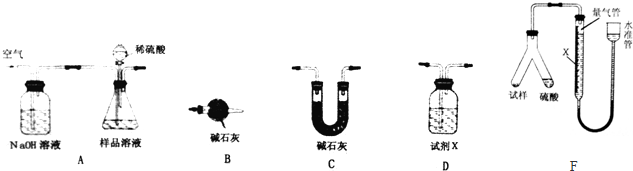
分析 (1)若剂X为足量的Ba(OH)2溶液,由A、B、D组成实验装置,则用沉淀法测定碳酸氢钠样品的纯度,即根据产生的二氧化碳与氢氧化钡反应生成沉淀的质量推算碳酸钠的质量,进而确定质量分数,在此实验中要将产生的二氧化碳全部被氢氧化钡吸收,同时要防止空气中的二氧化碳对实验的干扰;
(2)若试剂X为浓硫酸,则为根据产生二氧化碳的质量推算碳酸钠的质量,进而确定质量分数,实验时要防止空气中的二氧化碳对实验的干扰,据此确定装置的连接顺序,二氧化碳的质量是通过碱石灰的质量变化确定的;
(3)①二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差.
②a、测定气体体积时未冷却至室温,则测得的气体体积偏高;
b、水准管的液面高于量气管的液面,则气体压强大于大气压,会使测定的体积偏小;
c、原Y形管内有空气,后留有反应产生的气体不影响实验结果;
d、用排水集气法测定气体体积,量气管不需要干燥;
③量气管中测得生成的气体体积为VmL(标准状况),其物质的量为$\frac{V×1{0}^{-3}}{22.4}$mol,样品中NaHCO3的物质的量为$\frac{V×1{0}^{-3}}{22.4}$mol,根据纯度=$\frac{NaHC{O}_{3}的质量}{样品的质量}$×100%计算;
解答 解:(1)若剂X为足量的Ba(OH)2溶液,由A、B、D组成实验装置,则用沉淀法测定碳酸氢钠样品的纯度,即根据产生的二氧化碳与氢氧化钡反应生成沉淀的质量推算碳酸钠的质量,进而确定质量分数,反应的离子方程式为CO2+Ba2++2OH-═BaCO3↓+H2O,在此实验中要将产生的二氧化碳全部被氢氧化钡吸收,所以通入空气的作用是把生成的二氧化碳全部赶入装置D中,使之全部被氢氧化钡溶液吸收,同时要防止空气中的二氧化碳对实验的干扰,所以装置A中的氢氧化钠的作用是吸收空气中的二氧化碳等酸性气体,
故答案为:把生成的二氧化碳全部赶入装置D中,使之全部被氢氧化钡溶液吸收;吸收空气中的二氧化碳等酸性气体;CO2+Ba2++2OH-═BaCO3↓+H2O;
(2)若试剂X为浓硫酸,则为根据产生二氧化碳的质量推算碳酸钠的质量,进而确定质量分数,实验时要防止空气中的二氧化碳对实验的干扰,所以装置的连接顺序为ADCB,二氧化碳的质量是通过碱石灰的质量变化确定的,所以实验中要测定的物理量是装置C反应前后的质量,
故答案为:ADCB;装置C反应前后的质量;
(3)①二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差,
故答案为:饱和NaHCO3;
②a、测定气体体积时未冷却至室温,由于热胀冷缩,导致所测体积偏大,会使测定结果偏高;
b、气体压强大于大气压,会使测定的体积偏小,导致碳酸氢钠的测定结果偏低;
c、原Y形管内有空气,后留有反应产生的气体不影响实验结果;
d、用排水集气法测定气体体积,量气管不需要干燥,d项无影响,
故选b;
③量气管中测得生成的气体体积为VmL(标准状况),其物质的量为$\frac{V×1{0}^{-3}}{22.4}$mol,样品中NaHCO3的物质的量为$\frac{V×1{0}^{-3}}{22.4}$mol,根据纯度=$\frac{NaHC{O}_{3}的质量}{样品的质量}$×100%=$\frac{\frac{V×1{0}^{-3}}{22.4}×84}{m}$×100%=$\frac{3V}{8m}$%,
故答案为:$\frac{3V}{8m}$%.
点评 本题考查对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分溶液和胶体 | |
| B. | 能使湿润的监色石蕊试纸变红的气体是NH3 | |
| C. | 观察钾元素的焰色反应时要透过监色钴玻璃 | |
| D. | 检验溶液中SO42-存在时,先加盐酸酸化,再加氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁反应转移的电子数是3NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 7.8g Na2O2中含有阴离子数目为0.1NA,与足量水反应时电子转移了0.1NA | |
| D. | 标准状况下33.6L四氯化碳含有的分子数为1.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7… |
| CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
| A. | C26H54 | B. | C53H108 | C. | C54H110 | D. | C55H112 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把CO2通入CaCl2溶液中,有CaCO3沉淀生成 | |
| B. | 把SO2通入Ca(NO3)2溶液中,有CaSO3沉淀生成 | |
| C. | 把CO2通入Ca(ClO)2溶液中,有CaCO3沉淀生成,说明酸性:H2CO3>HClO | |
| D. | 把SO2通入Ca(ClO)2溶液中,有CaSO3沉淀生成,说明酸性:H2SO3>HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 氯水保存于棕色瓶中,用磨口玻璃塞密封放在阴凉处少量 | |
| D. | 含硫酸铜的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com