
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| B. | ③④处于同一周期 | |
| C. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
分析 短周期元素中,⑤有+7、-1价,则⑤为Cl;①有-2价,处于VIA族,原子半径小于Cl,故①为O;④、⑦都有+5、-3价,处于VA族,原子半径④>⑦,故④为P、⑦为N;③⑥都有+1价,处于IA族,原子半径P<③<⑥,则③为Li、⑥为Na;②、⑧的最高正化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径②>P,⑧<Cl,故②为Mg、⑧为B.
解答 解:短周期元素中,⑤有+7、-1价,则⑤为Cl;①有-2价,处于VIA族,原子半径小于Cl,故①为O;④、⑦都有+5、-3价,处于VA族,原子半径④>⑦,故④为P、⑦为N;③⑥都有+1价,处于IA族,原子半径P<③<⑥,则③为Li、⑥为Na;②、⑧的最高正化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径②>P,⑧<Cl,故②为Mg、⑧为B.
A.上述八种元素中,最高价氧化物对应水化物的酸性最强的是高氯酸,故A正确;
B.③为Li,④为P,分别处于第二、第三周期,故B错误;
C.元素⑤的氢化物为HCl,元素①的氢化物为水,水分子之间形成氢键,沸点高于HCl的,故C错误;
D.⑧为B元素,位于周期表中第二周期第ⅢA族,故D错误.
故选:A.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
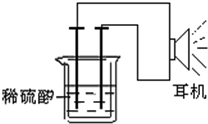 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
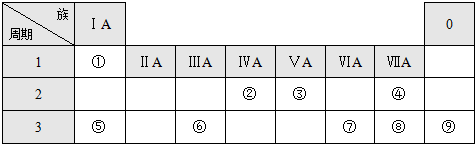
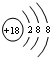 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;⑪
;⑪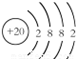 .
. ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ③④⑤ | D. | 全有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com