
| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反应 | ||
| C. | 苏打、小苏打水溶液的pH都大于7 | D. | I2,NH4Cl晶体受热都逐渐消失 |
分析 A.氯气和水反应生成的次氯酸具有漂白性,次氯酸具有强氧化性,二氧化硫和有色物质反应生成无色物质而具有漂白性;
B.苯酚和溴发生取代反应生成三溴苯酚沉淀,乙烯和溴发生加成反应生成1,2-二溴乙烷;
C.苏打、小苏打分别是碳酸钠、碳酸氢钠的俗称,碳酸钠、碳酸氢钠都能水解而使溶液呈碱性;
D.碘受热易升华,氯化铵受热易分解生成HCl和氨气.
解答 解:A.氯气和水反应生成的次氯酸具有漂白性,次氯酸具有强氧化性,二氧化硫和有色物质反应生成无色物质而具有漂白性,所以二者漂白原理不同,故A错误;
B.苯酚和溴发生取代反应生成三溴苯酚沉淀,乙烯和溴发生加成反应生成1,2-二溴乙烷,前者是取代反应、后者是加成反应,所以反应原理不同,故B错误;
C.苏打、小苏打分别是碳酸钠、碳酸氢钠的俗称,碳酸钠中碳酸根离子水解而使溶液呈碱性、碳酸氢钠中碳酸氢根离子水解导致溶液呈碱性,所以反应原理相同,故C正确;
D.碘受热易升华,氯化铵受热易分解生成HCl和氨气,前者是物理变化,后者是化学变化,所以原理不同,故D错误;
故选C.
点评 本题考查元素化合物性质,为高频考点,侧重考查学生比较、分析、判断能力,明确元素化合物性质、化学反应原理是解本题关键,注意次氯酸漂白性和二氧化硫漂白性的区别,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
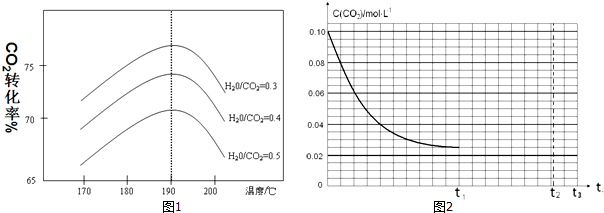
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 沸点:XW2>Y2W | |
| C. | 最高价氧化物对应的水化物的酸性:X>Z | |
| D. | 简单氢化物的热稳定性:Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通人H2S,有黄色沉淀 | |
| B. | 加入铜粉,溶液变为蓝色 | |
| C. | 加人锌粉,溶液棕黄色逐渐消失 | |
| D. | 滴加NaHCO3溶液,有气体和红棕色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
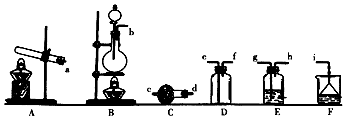
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 迷迭香酸属于芳香族化合物 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
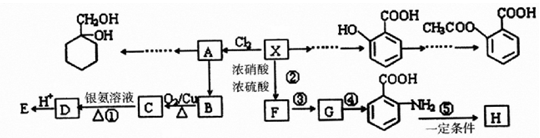
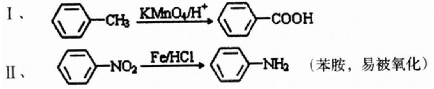
 ;
;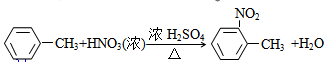 ;
;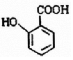 有多种同分异构体,写出符合下列条件的所有结构简式:
有多种同分异构体,写出符合下列条件的所有结构简式: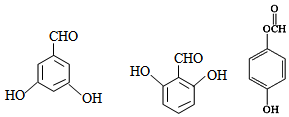 ;
;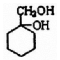 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)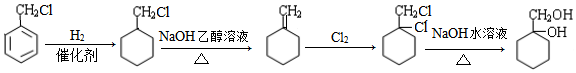 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com