
| A. | 将煤块粉碎后燃烧 | |
| B. | 用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 | |
| C. | 将食物贮藏在冰箱中 | |
| D. | 用双氧水溶液制氧气时添加少量二氧化锰粉末 |
科目:高中化学 来源: 题型:多选题
| A. | 溶液中c(B-)为1.6×10-3mol/L | |
| B. | 溶液中c(B-)为1.7×10-13mol/L | |
| C. | AB2比AC更难溶解 | |
| D. | 因两者不同类而无法比较其溶解度的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
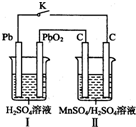 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1mol SO2 | |
| D. | 每生成2mol SO2的同时,消耗2mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
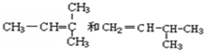
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2在Cl2中燃烧 | B. | 石灰石分解 | ||
| C. | Na和H2O的反应 | D. | Ba(OH)2•8H2O和NH4Cl固体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
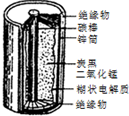 某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +319.68kJ•mol-1 | B. | +259.7kJ•mol-1 | C. | -319.68kJ•mol-1 | D. | -259.7kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com