
| A. | ①③④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ③④⑤ |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:M(?)+2N(g)═P(g)+Q(g)△H>0,
①平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故M、N、P的体积分数比为 1:1:1时不能作为判断是否达到平衡状态的依据,故①错误;
②M的状态未知,故气体的总质量是否变化未知,体积不变,故混合气体的密度不变时不一定能作为判断是否达到平衡状态的依据,故②错误;
③该反应为放热反应,体系的温度不变,说明达到平衡状态,故③正确;
④反应速率2v (N)正=v (Q)逆时,化学反应速率之比与化学计量数之比不等,故不能说明达到平衡状态,故④错误;
⑤容器为绝热容器,压强不变,说明体系的温度不变,说明达到平衡状态,故⑤正确;
⑥平均分子量=$\frac{总质量}{总物质的量}$,若M为气体,则总质量不变,总物质的量会变;若M不为气体,则总质量会变,总物质的量不变,故气体的平均相对分子质量不变时可作为判断是否达到化学平衡状态的依据,故⑥正确;
故一定达到平衡的标志是③⑤⑥,
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征和反应特征,平衡移动原理是解题关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气的摩尔质量是2克 | |
| B. | 20克氖气所含分子数为0.5NA(NA为阿伏加德罗常数) | |
| C. | 将20克NaOH固体溶于1L水所得溶液的物质的量浓度为0.5mol/L | |
| D. | 在相同温度和压强下,等质量的SO2和SO3所含硫原子个数比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
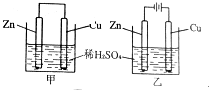 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )| A. | 甲乙装置中的铜片都作正极 | |
| B. | 甲乙装置中的溶液内的H+均在锌片上被氧化 | |
| C. | 甲乙装置中锌片上发生的反应都是还原反应 | |
| D. | 甲装置中铜片上有气泡生成,乙装置中的铜片质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O
+H2O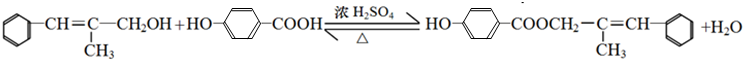
 .
.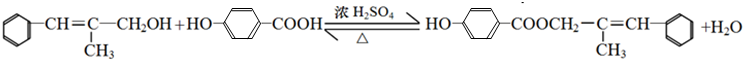
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、K+、SO42-、Cl-、Al[(OH)4]- | B. | Al3+、Na+、Cl-、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Fe2+、H+、Br-、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com