
| A. | 用激光笔检验豆浆的丁达尔现象 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 用萃取的方法分离汽油和煤油 |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:解答题
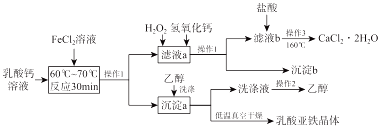
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示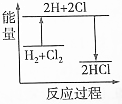 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电子从3s能级跃迁到3p能级形成的光谱是发射光谱 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为109°28′ | |
| C. | NO2- 中心原子采取sp2杂化,分子空间构型为“V”形 | |
| D. | 原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑨ | B. | ①②④⑨ | C. | ③⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无 | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.
A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com