
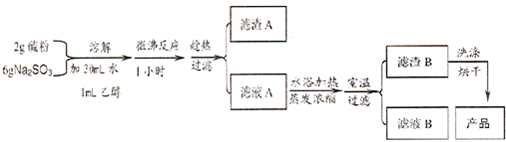
| 物理性质 | 易溶于水,不溶于乙醇;熔点 48.2℃;在潮湿的空气中易潮解 |
| 化学性质 | 43℃以上的空气中易风化;遇酸易分解 (S2O32-+2H+=S↓+SO2↑+H2O ) |


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
| B、向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| C、向AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O=A1O2-+4NH4++2H2O |
| D、向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
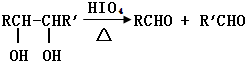
查看答案和解析>>
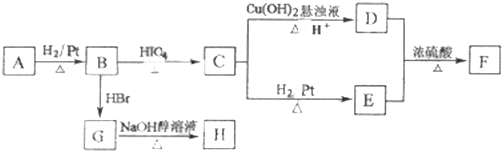
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1 mol?L-1碳酸钠溶液中的阴离子总数为0.1NA |
| B、将400 mL 1 mol/L的HNO3溶液与7 g Fe粉充分反应,转移电子数为0.375NA |
| C、标准状况下,14 g氮气中共用电子对的数目为1.5NA |
| D、已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中反应物的转化率为30%,相同条件下,当放出91.8 kJ热量时,生成氨分子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
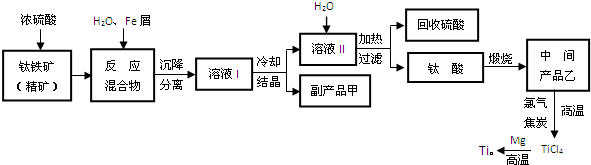
查看答案和解析>>
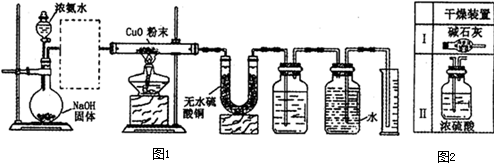
科目:高中化学 来源: 题型:
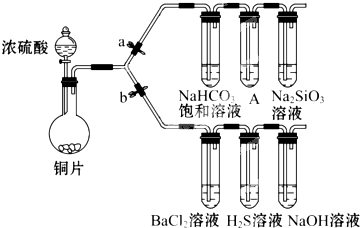 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com