
下列实验对应的结论正确的是:
| A | B | C | D |
装 置 |
|
|
|
|
结 论 | 实验室制取乙炔 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶 液反应生成的碘 | 白色沉淀是BaSO3 |
A
【解析】
试题分析:A.CaC2+2H2O Ca(OH)2+C2H2↑;由于该反应非常剧烈,所以用饱和NaCl溶液来代替水。乙炔难溶于水,用排水法收集。正确。B.HCl的酸性比碳酸强,所以会发生反应:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑,由于酸性碳酸大于硅酸,所以会发生反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓;由于HCl有挥发性,也会发生反应:Na2SiO3+2HCl=H2SiO3↓+2NaCl ,但是不能根据HCl的酸性强于碳酸,就确定非金属性Cl>C .错误。C.氯气置换出的碘单质能在水中溶解,因此不能用过滤的方法分离。错误。D.SO2有还原性,在酸性条件下与Ba(NO3)2发生氧化还原反应得到BaSO4沉淀。错误。
Ca(OH)2+C2H2↑;由于该反应非常剧烈,所以用饱和NaCl溶液来代替水。乙炔难溶于水,用排水法收集。正确。B.HCl的酸性比碳酸强,所以会发生反应:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑,由于酸性碳酸大于硅酸,所以会发生反应:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓;由于HCl有挥发性,也会发生反应:Na2SiO3+2HCl=H2SiO3↓+2NaCl ,但是不能根据HCl的酸性强于碳酸,就确定非金属性Cl>C .错误。C.氯气置换出的碘单质能在水中溶解,因此不能用过滤的方法分离。错误。D.SO2有还原性,在酸性条件下与Ba(NO3)2发生氧化还原反应得到BaSO4沉淀。错误。
考点:考查图像法在气体的制取、元素的非金属性的比较、混合物的分离、氧化还原反应中的应用的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5 mol·L-1·min-1 B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1 D.v(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:实验题
(17分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
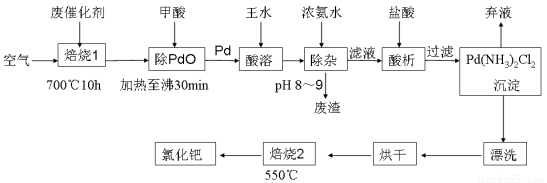
(1)甲酸还原氧化钯的化学方程式为 。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
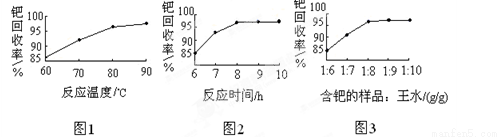
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ,反应时间约为 ,含钯的样品与王水的质量比为 。
(5)700℃“焙烧1”的目的是 , 550℃“焙烧2”的目的是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
一定条件下,发生反应:①M(s)+N(g)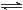 R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)
R(g) △H = -Q1 kJ·mol-1,②2R (g)+N(g)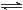 2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2 、Q3均为正值。下列说法正确的是
2T (g) △H = -Q2 kJ·mol-1。 Q1、Q2 、Q3均为正值。下列说法正确的是
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和
B.将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T (g)时(假定无热量损失),放出热量Q1+ kJ
kJ
D.M(g)+N(g)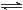 R(g) △H=-Q3 kJ·mol-1 , 则Q3 <Q1
R(g) △H=-Q3 kJ·mol-1 , 则Q3 <Q1
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:实验题
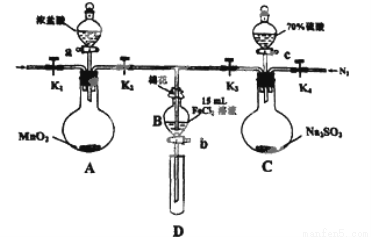
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:填空题
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH | SO | NO | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

① N2(g)+O2(g) 2NO(g)△H= 。
2NO(g)△H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
A.与W相邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素对应的氢化物稳定性最强的是H2Y
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:实验题
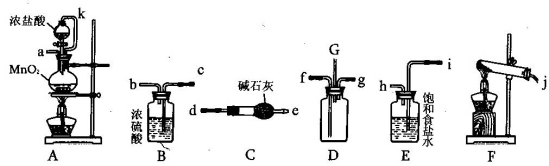
(15分)某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是__________________
(2)装置E的作用是____________,橡胶管k的作用是________________________
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是__________________
(4)装置F中试管内发生反应的化学方程式____________________________________
(5)接入D装置的两根导管左边较长、右边较短,目的是______________________________
(6)整套装置从左向右的连接顺序是(j)接( ) ( )接(f) (g)接( ) ( )接( ) ( )接(a).
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
A.对比等浓度的两种酸的pH
B.对比等浓度的两种酸,与相同大小镁条反应的初始速率
C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量
D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com