
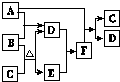
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: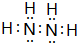 .
.分析 常见由两种元素组成且均含10个电子物质有HF、OH-、H2O、NH2-、NH3、H3O+、CH4、NH4+等,其中B既能与A反应也能与C反应,由转化关系可知B为OH-,A为H3O+,C为NH4+,D为H2O,E为NH3,F为NH3•H2O.
解答 解:常见由两种元素组成且均含10个电子物质有HF、OH-、H2O、NH2-、NH3、H3O+、CH4、NH4+等,其中B既能与A反应也能与C反应,由转化关系可知B为OH-,A为H3O+,C为NH4+,D为H2O,E为NH3,F为NH3•H2O.
(1)A为H3O+,含有3个σ键和1个孤电子对,空间构型为三角锥形,C为NH4+,含有4个σ键,没有孤电子对,空间构型为正四面体结构,
故答案为:三角锥形;正四面体;
(2)等电子体是指具有原子总数相同、价电子总数相同的微粒,六种物质中H3O+、NH3互为等电子体,
故答案为:H3O+、NH3;
(3)A~E五种微粒中含有配位键的有H3O+、NH4+,
故答案为:H3O+、NH4+;
(4)与E(NH3)所含元素相同的18电子分子为 N2H4,其电子式为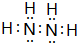 ,
,
故答案为:N2H4;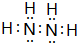 ;
;
(5)NH3极易溶于H2O,其主要原因是NH3与H2O分子之间形成氢键,
故答案为:NH3与H2O分子之间形成氢键;
(6)将过量的NH3•H2O滴加到CuSO4溶液中,生成[Cu(NH3)4]2+,溶液呈深蓝色的溶液,向该深蓝色的溶液中加入乙醇,析出深蓝色固体,加入乙醇的作用是降低[Cu(NH3)4]SO4的溶解度,将得到的深蓝色固体中的2个配体用Cl-取代,可得到两种产物,该深蓝色固体中配离子的立体构型为平面正方形,
故答案为:降低[Cu(NH3)4]SO4的溶解度;平面正方形.
点评 本题考查无机物的推断,基本属于猜测验证型题目,需要学生熟练掌握常见10电子和18电子物质的种类和性质,侧重于学生的分析能力的考查,学习中注意相关基础知识的积累.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 中性溶液中:Fe3+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中:Na+、ClO-、SO42-、I- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.
双氧水最主要的用途是漂白和杀菌消毒,在环境保护、化学合成和工业生产中有着广泛的应用.查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
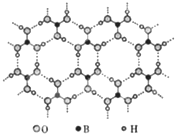 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )| A. | 正硼酸晶体属于分子晶体 | B. | H3BO3分子的稳定性与氢键有关 | ||
| C. | 分子中硼原子最外层不是8e-结构 | D. | 含1mol H3BO3的晶体中有3mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
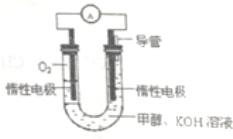 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com