
在2 L的密闭容器中,发生以下反应:2A(g) + B(g) 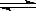 2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
A.0.6 mol B.1.2 mol C.2.4 mol D.1.8 mol
科目:高中化学 来源: 题型:
NO是一种剧毒气体,但近年来发现许多生物体组织中存在少量NO,它有扩张血管、增强免疫、增强记忆力的功能,因而成为当前生命科学的研究热点。
(1)写出自然界形成NO的化学方程式:______________________________________。
(2)地球外层空间存在着微量的臭氧和氧原子,臭氧层的存在能吸收和阻挡太阳中有害的紫外线辐射,人为大气污染可破坏臭氧层,如超音速飞机排放物中的氮氧化物可在大气层中发生反应:
NO+O3===NO2+O2 ①
NO2+O===NO+O2 ②
①上述反应①中,NO是__________剂,上述反应②中,NO是________产物。
②整个过程中的总反应方程式为__________________________________。
③整个过程中NO所起的作用是________。
(3)为了消除NO对环境的污染,根据氧化还原反应原理,可选用NH3使NO与之反应转化为两种无毒气体(其中之一是水蒸气),该反应需要催化剂参加,其化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
给你提供纯锌、纯铜片和500 mL 0.4 mol·L-1的H2SO4溶液、导线、1 000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
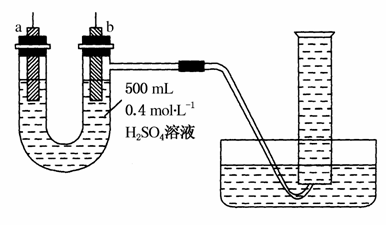
(1)如图所示,装置气密性良好,且1 000 mL量筒中已充满了水,则开始实验时,首先要_____________________________。
(2)a电极材料为________,其电极反应式为_______________
b电极材料为________,其电极反应式为__________________。
(3)当量筒中收集672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
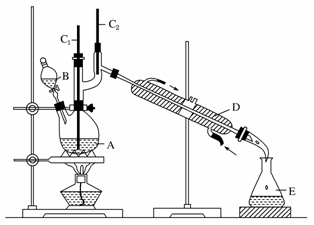
发生的反应如下:
CH3CH2CH2CH2OH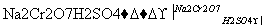 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由________________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是_______________________________________________________ ______________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是________________________。
(7)本实验中,正丁醛的产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 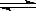 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
A.N2O4的消耗速率与NO2的生成速率之比为1∶2;
B.烧瓶内气体的颜色不再加深;
C.烧瓶内气体的平均相对分子质量不再变化;
D.烧瓶内气体的压强不再变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、Y为5种短周期元素。
①A、B、D位于同一周期,D、Y位于同一主族。A的原子的最外层电子数是其次外层电子数的2倍。
②D的氢化物是最常用的溶剂,E的单质是一种生活中常见的金属。
请回答:
(1)AD2中具有的化学键的类型是 。
(2)高温时,6 gA的单质与D的气态氢化物反应,生成两种还原性气体,吸收的热量为65.75 kJ,其反应的热化学方程式是 。
(3)D与氢元素可组成含有10个电子的X一,与X一组成元素相同,原子数个数比也相同的分子的电子式是 。
(4)YD2气体通入足量BaCl2和B的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
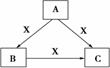
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A.若X为Cl2,则C可为FeCl3
B.若X为KOH溶液,则A可为AlCl3
C.若X为O2,则A可为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A
和1.0 mol B,反应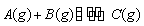 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A、反应在前5 s的平均速率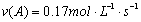
B、保持其他条件不变,升高温度,平衡时 ,则反应的
,则反应的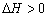
C、相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com