
海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.NaOH c.Mg(OH)2 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 。所以,为了抑制MgCl2·6H2O在加热时水解,可在干燥的
气流中加热,可得到无水氯化镁。
(5)用惰性电极电解熔融的MgCl2,阳极的电极反应式为: ;
如果电解MgCl2溶液,阴极的电极反应式为: 。
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,分别对反应C(s)+CO2(g)2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④
C.①② D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中各组离子一定能大量共存的是 ( )
A.使甲基橙呈红色的溶液中:Na+、AlO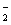 、NO
、NO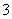 、CO
、CO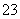
B.由水电离产生的c(H+)=10-12mol·L?-1的溶液:NH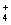 、SO
、SO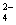 、HCO
、HCO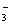 、Cl-
、Cl-
C.含有0.1 mol·L-1 HCO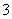 的溶液:Na+、Fe3+、NO
的溶液:Na+、Fe3+、NO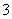 、SCN-
、SCN-
D. 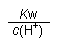 =0.1 mol·L-1的溶液:Na+、K+、CO
=0.1 mol·L-1的溶液:Na+、K+、CO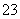 、NO
、NO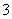
查看答案和解析>>
科目:高中化学 来源: 题型:
若pH=3的酸溶液和pH=11的碱溶液等体积混合后 溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和二元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时有关弱电解质的电离平衡常数如下表:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0–5 | 4.9×l0–10 | K1=4.3×l0–7 K2=5.6×l0–11 | 1.8×l0–5 |
根据上表中数据回答下列问题:
(1)CH3COO- 、CN- 、CO32-结合质子(即H+)的能力大小顺序___________________________;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为 (填序号)。
(2) NaCN溶液中通入少量二氧化碳,反应的离子方程式为
(3)室温下,向盛一定量的稀氨水烧杯中逐滴加入物质的量浓度相同的醋酸,当恰好中和时,溶液的pH 7(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.除去MgCl2溶液中混有少量AlCl3 ,用氨水和盐酸
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.金属原子只有还原性,金属阳离子只有氧化性
D.用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Cu、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
A.3.2 g B.2.4 g C.1.6 g D.0.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )
| 硫酸化学纯(CP)(500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g·cm-3 质量分数:98% |
A.该硫酸的浓度为9.2 mol·L-1
B.配制200 mL 4.6 mol·L-1的稀H2SO4需该H2SO450 mL
C.该硫酸与等体积水混合质量分数变为49%
D.取该硫酸100 mL,则浓度变为原来的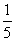
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com