A
分析:选项中的各种物质和氢氧化钠反应的方程式为:2Al+6H
2O+2NaOH═2Al(OH)
3↓+3H
2↑,
Al(OH)
3+NaOH═NaAlO
2+2H
2O,
AlCl
3+3NaOH(少量)═Al(OH)
3↓+3NaCl,
Al(OH)
3+NaOH(过量)═NaAlO
2+2H
2O,总反应式:AlCl
3+4NaOH(过量)═NaAlO
2+3NaCl+2H
2O,
Al
2O
3+2NaOH═2NaAlO
2+H
2O,在各物质质量相等的条件下,计算消耗的碱量.
解答:假设各种物质的质量均为1g,则铝单质的物质的量为
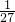
mol,氢氧化铝的物质的量为
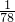
mol,氯化铝的物质的量为

mol,氧化铝的物质的量为

mol,
根据化学方程式:2Al+6H
2O+2NaOH═2Al(OH)
3↓+3H
2↑;
Al(OH)
3+NaOH═NaAlO
2+2H
2O;AlCl
3+3NaOH(少量)═Al(OH)
3↓+3NaCl,Al(OH)
3+NaOH(过量)═NaAlO
2+2H
2O,总反应式:AlCl
3+4NaOH(过量)═NaAlO
2+3NaCl+2H
2O;
Al
2O
3+2NaOH═2NaAlO
2+H
2O,
则Al~NaOH,消耗碱
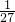
mol,
Al(OH)
3~NaOH,消耗碱
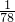
mol,
AlCl
3~4NaOH,消耗碱4×

mol,
Al
2O
3,~2NaOH,消耗碱2×

mol,所以消耗碱量最多的是铝.
故选A.
点评:本题考查学生有关铝及其化合物和强碱氢氧化钠反应的化学性质、化学方程式的书写知识,难度较大.

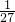 mol,氢氧化铝的物质的量为
mol,氢氧化铝的物质的量为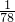 mol,氯化铝的物质的量为
mol,氯化铝的物质的量为 mol,氧化铝的物质的量为
mol,氧化铝的物质的量为 mol,
mol,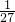 mol,
mol,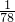 mol,
mol, mol,
mol, mol,所以消耗碱量最多的是铝.
mol,所以消耗碱量最多的是铝.
