
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
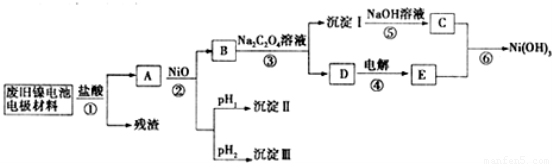
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ ?????? 和沉淀Ⅲ ????? (填化学式),则pH1 ???????? pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 ?????? 。
A.pH试纸???????? B.石蕊指示剂 ?????? C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 ???????????????????????? .第③步反应后,过滤沉淀时需要的玻璃仪器有???? .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 ????????????? 、???????????? 。
(3)④中阳极反应产生的气体E为 ??????????? ,验证该气体的试剂为 ???????? 。
(4)试写出反应⑥的离子方程式_____________________________________________
(1)Fe(OH)3??? Al(OH)3? ? <???? C?? (4分)
(2)NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O+2NaCl? (2分)
烧杯、漏斗、玻璃棒;(3分) 滤纸破损、过滤液的液面高于滤纸的边缘(2分)
(3)Cl2????? 湿润的淀粉碘化钾试纸(2分)
(4)2Ni(OH)2+Cl2+2OH—=2Nii(OH)3+2Cl—(2分)
【解析】
试题分析:(1)根据金属氢氧化物的Kap及沉淀析出的理论pH,结合流程图可知,先沉淀的是三价铁离子,随后沉淀的是三价铝离子,控制两种沉淀析出必须准确测定溶液PH,所以用PH计测定,故答案为:沉淀Ⅱ是Fe(OH)3 ,沉淀Ⅲ是Al(OH)3 ,PH1<PH2,C;
(2)由溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O和流程中的变化可知沉淀为溶解度小的NiC2O4·2H2O,所以根据转化关系写出化学方程式;在过滤装置中用到的玻璃仪器和注意问题,根据装置和操作步骤写出NiCl2+Na2C2O4+2H2O=NiC2O4.2H2O↓+2NaCl,故答案为:NiCl2+Na2C2O4+2H2O=NiC2O4.2H2O↓+2NaCl; 漏斗、玻璃棒、烧杯;玻璃棒划破滤纸、滤液超过滤纸边缘;
(3)D溶液时氯化钠溶液,电解反应方程式2NaCI+2H2O 2NaOH+Cl2↑+H2↑,E气体为Cl2,故答案:Cl2,淀粉碘化钾溶液;
2NaOH+Cl2↑+H2↑,E气体为Cl2,故答案:Cl2,淀粉碘化钾溶液;
(4)根据转化关系和Ni2+沉淀的PH推知,加入氢氧化钠的主要目的是把NiC2O4·2H2O沉淀转化为Ni(OH)2沉淀,为了使沉淀完全转化,加入的氢氧化钠溶液应过量,根据镍元素化合价变化,结合氧化还原反应的规律写出离子方程2Ni(OH)2+2OH-+Cl2=2Ni(OH)3 +2Cl-;
考点:考查金属回收的基本方法、难溶电解质的溶解与沉淀应用、沉淀转化的条件,铝、铁、镍元素化合物的化学性质,离子的沉淀PH范围,物质的分离、提纯的方法,实验基本操作等。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:

| M(OH)n | Ksp | ||
| pH | |||
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
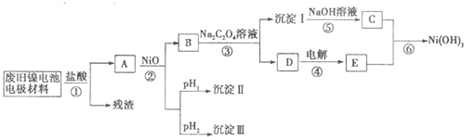
| M(OH)n | Kap | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源:2013届四川省雅安中学高三1月月考化学试卷(带解析) 题型:填空题
(12分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: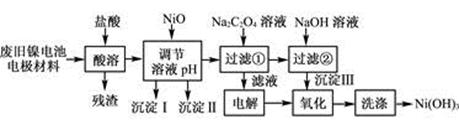
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省高三1月月考化学试卷(解析版) 题型:填空题
(12分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
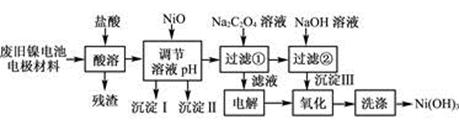
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)n |
Ksp |
开始沉淀pH |
沉淀完全pH |
|
Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
|
Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
|
Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:
。
(3) 检验电解滤液时阳极产生的气体的方法:
。
(4) 写出“氧化”反应的离子方程式:
。
(5) 如何检验Ni(OH)3已洗涤干净?
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:实验题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)n |
Ksp |
|
|
|
pH |
|
|
|
|
开始沉淀 |
沉淀完全 |
|
|
|
Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
|
Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
|
Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式: 。
(3) 检验电解滤液时阳极产生的气体的方法: 。
(4) 写出“氧化”反应的离子方程式: 。
(5) 如何检验Ni(OH)3已洗涤干净? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com