
| A. | 氯化钠溶液 | B. | 金属铜 | C. | 熔融硫酸钠 | D. | 氯化氢气体 |
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个二氧化碳分子和0.5mol甲烷的质量比为11:4 | |
| B. | 1molCl2作为氧化剂得到的电子数为NA | |
| C. | 在0℃,101kPa时,11.2L氢气中含有0.5NA个氢原子 | |
| D. | 14g氮气中含有7NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
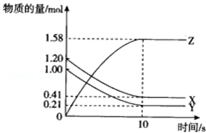 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4++H2O?NH3•H2O+H+ | B. | NH3•H2O?NH4++OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com