
分析 (1)根据离子之间结合生成沉淀,不能共存,确定含有的两种物质;
(2)C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝;
(3)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,该气体为NO2,说明D中含有NO3-.
解答 解:(1)因Al3+、Mg2+、Fe3+和OH-反应生成沉淀,Al3+、Mg2+、Ba2+、Fe3+和CO32-反应,则不能共存,所以一定存在的物质为Na2CO3 和 Ba(OH)2,
故答案为:Na2CO3;Ba(OH)2;
(2)C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝,
①因C为硫酸铁,则阴离子有SO42-,则X为SO42-,
故答案为:B;
②则B为Na2CO3,碳酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),氢氧根离子来自碳酸根离子的水解和水的电离,则c(OH-)>c(HCO3-),则溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
(3)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,该气体为NO2,说明D中含有NO3-,反应离子方程式为:3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O,
故答案为:NO3-;3Cu+8H++2NO3-═3Cu2+2NO↑+4H2O.
点评 本题考查常见离子的检验方法,题目难度中等,综合度较高,旨在考查学生的推断能力与方案设计能力,注意根据反应现象进行推断,试题培养了学生的分析能力及灵活应用能力.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:填空题
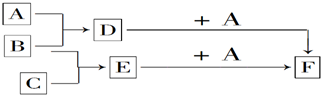
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
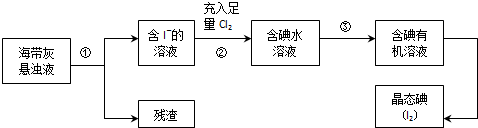
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
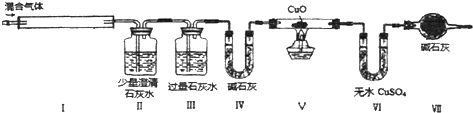
| A. | 混合气体中一定有NO2和CO | |
| B. | 混合气体中一定没有H2和NH3 | |
| C. | 混合气体中一定含有H2、NO、CO2、HCl四种气体 | |
| D. | 不能确定混合气体中是否有NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 向0.1mol•L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,紫红色KMnO4 溶液褪色,说明Fe2+具有还原性 | |
| D. | 向某溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 双氢青蒿素属于酯类物质 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素环上的一氢取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com