
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
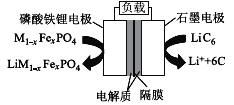
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
科目:高中化学 来源: 题型:
【题目】三氧化二铟(In2O3)是一种透明的导电材料,可运用于接触屏、液晶显示器等高科技领域;铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分In(OH)3,常温下Ksp[In(OH)3]=l.41×10-33]制备In2O3的工艺流程如下:

(1)写出水铟矿被硫酸酸浸的离子方程式_____________________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:________、_______、过滤、洗涤、干燥。
(3)某研究机构用硫酸提取铟时,酸度(每升溶液中含硫酸的质量)与浸出率关系如图

①当酸度为196时,硫酸物质的量浓度为______________。
②请选择适宜的酸度值:___________,并说明选择的理由____________。
(4)完成下列方程式:
(_____)In(NO3)3![]() (_____)In2O3+(_____) _______↑+(_____) _______↑
(_____)In2O3+(_____) _______↑+(_____) _______↑
(5)高纯铟与浓硝酸反应过程中产生的NO2气体可被过氧化钠直接吸收,则标准状况下448mlNO2可被______gNa2O2吸收,NO2的排放会引起一系列的环境问题,任写一条其引起的环境问题___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的氧化物成分不一样,性质也不一样, H2还原Fe2O3,发现温度不同,产物也不同。
(1)往产物中滴加盐酸,观察到有气泡产生,生成气泡主要成分的电子式是________。
(2)再滴加KSCN溶液,可观察到________,所得溶液中一定含有的铁的化合价是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物是带来人类文明的重要物质![]() 下列说法正确的是
下列说法正确的是![]()
![]()
A.某硅酸盐的化学式为![]() ,可用
,可用![]() 表示
表示
B.水玻璃是纯净物,可用于生产黏合剂和防火剂
C.陶瓷、水晶、水泥、玻璃都属于硅酸盐
D.高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Al与CuCl2溶液反应,实验如下:下列说法不正确的是( )
实验 | 现象 |
| a.Al片表面附着蓬松的红色固体 b.产生无色气体,起始速率较慢,之后加快 c.反应放热 d.烧杯底部产生少量不溶于稀盐酸的白色沉淀 e.溶液pH降低 |
A.无色气体是H2
B.实验中影响化学反应速率的因素只有两个,分别是浓度和温度
C.白色沉淀的出现与氧化还原反应有关
D.将铝片改为铝粉会加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )
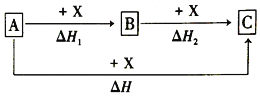
①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2
A.②③④⑥B.②③④⑤⑥
C.①②③④⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9kJ热量。则H2燃烧的热化学方程式为_____
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4kJ/mol
2NH3(g);ΔH=-92.4kJ/mol
①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中加入催化剂引起反应速率变化的时间段是____(填,如0~t1等)。
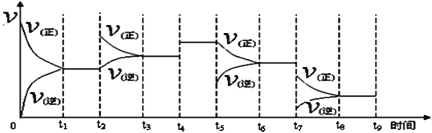
②生产中为提高反应速率和H2的转化率,下列措施可行的是___(填字母)。
A.向装置中充入过量N2 B.及时将合成的氨气从装置中分离出来
C.使用更高效的催化剂 D.升高温度
③温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是200mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(t)变化的关系曲线。(已知草酸锰不稳定,但其中锰元素的化合价在300℃以下不变)

试回答下列问题:
(1)写出B点固体产物的化学式________________________________________;
(2)通过计算确定D点处产物的化学式______________________________。
(3)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_____________________________________________。
(4)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

(5)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com