
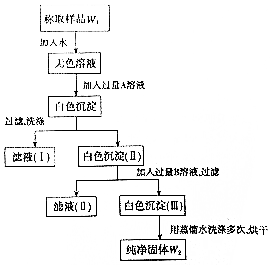
 实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.
实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.分析 称取样品W1g加入水溶解得到无色溶液,加入过量A溶液为BaCl2溶液,得到硫酸钡沉淀、亚硫酸钡沉淀,过滤洗涤得到滤液Ⅰ和白色沉淀Ⅱ,加入过量B溶液是溶液使亚硫酸钠溶解,过滤得到滤液Ⅱ和沉淀Ⅲ为硫酸钡沉淀,用蒸馏水洗涤多次烘干得到纯净固体W2g,
(1)加入过量A溶液使为了沉淀完全硫酸根离子和亚硫酸根离子;检验A是否过量,可以取上层清液加入氯化钡观察是否有沉淀生成设计;
(2)分析可知B是溶解亚硫酸钡沉淀的试剂,硫酸钡不溶于酸,试剂不能引入硫酸根离子,所以B为盐酸溶液,过量是为了全部溶解亚硫酸钡沉淀;
(3)检验沉淀(Ⅲ)是否洗涤干净应取最后一次洗涤液加入硝酸酸化的硝酸银检验是否含氯离子或检验是否含硫酸根离子设计检验方法;
(4)W1为Na2SO3和Na2SO4质量,W2为BaSO4质量,计算硫酸钡物质的量得到样品中硫酸钠物质的量,计算得到质量,用样品质量减去硫酸钠质量为亚硫酸钠质量,得到亚硫酸钠的质量分数;
(5)亚硫酸钠被全部氧化生成硫酸钠,2Na2SO3+O2=2Na2SO4,若生成硫酸钡物质的量和和硫酸钠物质的量相同时说明完全氧化.
解答 解:称取样品W1g加入水溶解得到无色溶液,加入过量A溶液为BaCl2溶液,得到硫酸钡沉淀、亚硫酸钡沉淀,过滤洗涤得到滤液Ⅰ和白色沉淀Ⅱ,加入过量B溶液为是溶液使亚硫酸钠溶解,过滤得到滤液Ⅱ和沉淀Ⅲ为硫酸钡沉淀,用蒸馏水洗涤多次烘干得到纯净固体W2g,
(1)加入过量A为BaCl2溶液使为了使 SO32-、SO42- 沉淀完全,检验BaCl2是否过量的方法是取上层清液少量,再加BaCl2溶液少量,若无沉淀生成,证明所加BaCl2溶液已过量或取上层清液少量,再加入Na2SO4溶液少量,若有沉淀生成,证明所加BaCl2溶液已过量,加入A后发生反应的离子方程式为Ba2++SO42-=BaSO4↓,Ba2++SO32-=BaSO3↓,
故答案为:BaCl2溶液;使 SO32-、SO42- 沉淀完全,取上层清液少量,再加BaCl2溶液少量,若无沉淀生成,证明所加BaCl2溶液已过量或取上层清液少量,再加入Na2SO4溶液少量,若有沉淀生成,证明所加BaCl2溶液已过量;Ba2++SO42-=BaSO4↓,Ba2++SO32-=BaSO3↓;
(2)分析可知B是溶解亚硫酸钡沉淀的试剂,硫酸钡不溶于酸,试剂不能引入硫酸根离子,所以B为盐酸溶液,加入B为盐酸稍过量的理由是把亚硫酸钡沉淀全部溶解,加入B发生反应的离子方程式是 BaSO3+2H+=Ba2++SO2↑+H2O,
故答案为:盐酸;使BaSO3 全部溶解,BaSO3+2H+=Ba2++SO2↑+H2O;
(3)检验沉淀(Ⅲ)是否洗涤干净应取最后一次洗涤液加入硝酸酸化的硝酸银检验是否含氯离子或检验是否含硫酸根离子设计检验方法,步骤为:取最后一次洗涤液少量,加入用稀HNO3酸化的AgNO3溶液,若无沉淀产生,表示沉淀已经洗净,
故答案为:用稀HNO3酸化的AgNO3溶液,无沉淀产生;
(4)W1为Na2SO3和Na2SO4质量,W2为BaSO4质量,n(BaSO4)=n(Na2SO4)=$\frac{{W}_{2}}{233}$mol,用样品质量减去硫酸钠质量为亚硫酸钠质量,得到亚硫酸钠的质量分数=$\frac{{W}_{1}-\frac{{W}_{2}}{233}×142}{{W}_{1}}$×100%=(1-$\frac{{W}_{2}}{{W}_{1}}$×$\frac{142}{233}$)×100%,
故答案为:(1-$\frac{{W}_{2}}{{W}_{1}}$×$\frac{142}{233}$)×100%;
(5)亚硫酸钠被全部氧化生成硫酸钠,2Na2SO3+O2=2Na2SO4,若生成硫酸钡物质的量和和硫酸钠物质的量相同时说明完全氧化,$\frac{{W}_{2}}{233}$mol×142g/mol=W1,则142W2
=233W1,
故答案为:142W2=233W1.
点评 本题考查物质组成和含量的测定实验过程分析判断,主要是物质性质,物质分离等知识点,主要是实验过程的理解和计算应用,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:多选题
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
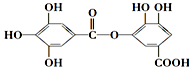
| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com