
ΓΨΧβΡΩΓΩNiCl2 «Μ·ΙΛΚœ≥…÷–Ήν÷Ί“ΣΒΡΡχ‘¥Θ§ΙΛ“Β…œ“‘Ϋπ τΡχΖœΝœ(Κ§FeΓΔCaΓΔMgΒ»‘”÷ )ΈΣ‘≠Νœ…ζ≤ζNiCl2Θ§ΦΧΕχ…ζ≤ζNi2O3ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ

Νς≥Χ÷–œύΙΊΫπ τάκΉ”…ζ≥…«β―θΜ·Έο≥ΝΒμΒΡpH»γœ¬±μΥυ ΨΘΚ
«β―θΜ·Έο | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
ΩΣ Φ≥ΝΒμΒΡpH | 1.1 | 6.5 | 7.1 |
≥ΝΒμΆξ»ΪΒΡpH | 3.2 | 9.7 | 9.2 |
Θ®1Θ©ΈΣΝΥΧαΗΏΡχ‘ΣΥΊΒΡΫΰ≥ω¬ Θ§‘ΎΓΑΥαΫΰΓ± ±Ω…≤…»ΓΒΡ¥κ ©”–ΘΚΔΌ Β±…ΐΗΏΈ¬Ε»ΘΜΔΎΫΝΑηΘΜΔέ_______________Β»ΓΘ
Θ®2Θ©Φ”»κH2O2ΒΡΡΩΒΡ «____________Θ§ΥυΖΔ…ζΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____________________ΓΘ
Θ®3Θ©ΓΑ≥ΐΧζΓ± ±Θ§ΩΊ÷Τ»ή“ΚpHΒΡΖΕΈßΈΣ_____________________ΓΘ
Θ®4Θ©¬Υ‘ϋBΒΡ÷ς“Σ≥…Ζ÷ΒΡΜ·―ß ΫΈΣ___________________Θ§¬Υ“Κ÷–ΒΡ―τάκΉ””–________ΓΘ
Θ®5Θ©ΓΑ―θΜ·Γ±…ζ≥…Ni2O3ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ________________ΓΘ
ΓΨ¥πΑΗΓΩ‘ω¥σ―ΈΥαΒΡ≈®Ε»(ΜρΫΪΡχΖœΝœ―–≥…ΖέΡ©Μρ―”≥ΛΫΰ≈ί ±ΦδΒ») Fe2ΘΪΉΣΜ·≥…Fe3ΘΪ 2Fe2ΘΪΘΪH2O2ΘΪ2HΘΪ===2Fe3ΘΪΘΪ2H2O 3.2ΓΪ7.1 MgF2ΓΔCaF2 NH4+ΓΔNa+ 2Ni2ΘΪΘΪClOΘ≠ΘΪ4OHΘ≠===Ni2O3ΓΐΘΪClΘ≠ΘΪ2H2O
ΓΨΫβΈωΓΩ
ΗυΨίΙΛ“’Νς≥ΧΖ÷ΈωΩ…÷ΣΘ§œρΫπ τΡχΖœΝœ÷–Φ”»κ―ΈΥαΥαΫΰΘ§–Έ≥…Ni2+ΓΔFe2+ΓΔCa2+ΚΆMg2+ΒΡ»ή“ΚΘ§‘Όœρ»ή“Κ÷–Φ”»κH2O2ΫΪFe2+―θΜ·≥…Fe3+Θ§Φ”»κNa2CO3»ή“ΚΒςΫΎpH ΙΒΟFe3+≥ΝΒμΘ§ΒΟΒΫ¬Υ‘ϋAΈΣFe(OH)3Θ§‘ΌΦ”»κNH4F ΙΒΟMg2+ΚΆCa2+≥ΝΒμΘ§ΒΟΒΫ¬Υ‘ϋBΈΣCaF2ΚΆMgF2Θ§ΦΧ–χœρ¬Υ“Κ÷–Φ”»κNa2CO3≥ΝΡχΘ§‘ΌΦ”»κ―ΈΥα»ήΫβΘ§œρ»ή“Κ÷–Φ”»κNaClOΚΆNaOH―θΜ·ΒΟΒΫNi2O3Θ§Ψί¥ΥΖ÷ΈωΫβ¥πΈ ΧβΓΘ
(1)ΈΣΝΥΧαΗΏΫπ τΡχΖœΝœΫΰ≥ωΒΡΥΌ¬ Θ§ΜΙΩ…“‘‘ω¥σ―ΈΥαΒΡ≈®Ε»(ΜρΫΪΡχΖœΝœ―–≥…ΖέΡ©Μρ―”≥ΛΫΰ≈ί ±ΦδΒ»)Θ§Ι ¥πΑΗΈΣΘΚ‘ω¥σ―ΈΥαΒΡ≈®Ε»(ΜρΫΪΡχΖœΝœ―–≥…ΖέΡ©Μρ―”≥ΛΫΰ≈ί ±ΦδΒ»)ΘΜ
(2)ΗυΨί…œ ωΖ÷ΈωΘ§Φ”»κH2O2ΒΡΡΩΒΡ «ΫΪFe2+―θΜ·≥…Fe3+Θ§ΗυΨί―θΜ·ΜΙ‘≠Ζ¥”ΠΙφ¬…ΒΟ≥ωΤδάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣ2Fe2ΘΪΘΪH2O2ΘΪ2HΘΪ===2Fe3ΘΪΘΪ2H2OΘ§Ι ¥πΑΗΈΣΘΚFe2+ΉΣΜ·≥…Fe3+ΘΜ2Fe2+ΘΪH2O2ΘΪ2H+===2Fe3+ΘΪ2H2OΘΜ
(3)≥ΝΡχ«Α“ΣΫΪFe3+≥ΝΒμΆξ»ΪΘ§ΕχΡχάκΉ”≤ΜΡή≤ζ…ζ≥ΝΒμΘ§ΗυΨί±μ÷–ΥυΗχ–≈œΔΩ…÷ΣΘ§Fe3+Άξ»Ϊ≥ΝΒμΒΡpH÷ΒΈΣ3.2Θ§ΡχάκΉ”ΩΣ Φ≥ΝΒμΒΡpH÷ΒΈΣ7.1Θ§Υυ“‘»ή“ΚΒΡpH÷ΒΩΊ÷Τ‘Ύ3.2ΓΪ7.1Θ§Ι ¥πΑΗΈΣΘΚ3.2ΓΪ7.1ΘΜ
(4)ΗυΨί“‘…œΖ÷ΈωΩ…÷ΣΘ§¬Υ‘ϋBΒΡ÷ς“Σ≥…Ζ÷ΒΡΜ·―ß ΫΈΣMgF2ΓΔCaF2Θ§ΥυΒΟΒΡ¬Υ“Κ÷–÷ς“ΣΚ§”–NH4+ΚΆNa+Θ§Ι ¥πΑΗΈΣΘΚMgF2ΓΔCaF2ΘΜNH4+ΓΔNa+ΘΜ
(5)ΓΑ―θΜ·Γ±Ιΐ≥ΧΖΔ…ζΒΡΖ¥”Π÷–Θ§Cl‘ΣΥΊ”…+1ΦέΫΒΒΆΒΫ-1ΦέΘ§Φ¥Ζ¥”Π…ζ≥…NaClΘ§ΕχNi”…+2Φέ…ΐΗΏΒΫ+3ΦέΘ§…ζ≥…Ni2O3Θ§Ζ¥”ΠάκΉ”ΖΫ≥Χ ΫΈΣΘΚ2Ni2ΘΪΘΪClOΘ≠ΘΪ4OHΘ≠===Ni2O3ΓΐΘΪClΘ≠ΘΪ2H2OΘ§Ι ¥πΑΗΈΣΘΚ2Ni2ΘΪΘΪClO-ΘΪ4OH-===Ni2O3ΓΐΘΪCl-ΘΪ2H2OΓΘ


 Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Β―ι “≥Θ”ΟΦν–‘»ή“ΚΈϋ ’Εύ”ύΒΡ¬»ΤχΘ§Ζά÷ΙΜΖΨ≥Έέ»ΨΓΘΡ≥¥Έ Β―ι÷–Θ§ΫΪΕύ”ύΒΡ¬»Τχ”Ο100 mL 2.00 molΓΛL1ΒΡNaOH»ή“Κ«ΓΚΟΆξ»ΪΈϋ ’Θ§≤βΒΟΈϋ ’“Κ÷–ClO”κClO3ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ5:1ΓΘ
Θ®1Θ©Έϋ ’ΒΡ¬»ΤχΒΡΈο÷ ΒΡΝΩΈΣ_____________ΓΘ
Θ®2Θ©Έϋ ’“Κ÷–ClΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ______________(»ή“ΚΧεΜΐ±δΜ·Κω¬‘≤ΜΦΤ)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»Γa molΡ≥Κ§―θ―ή…ζΈοΒΡ’τΤχΘ§ ΙΤδ”κ2a mol O2ΜλΚœΒψ»ΦΘ§ΝΫ’Ώ«ΓΚΟΆξ»ΪΖ¥”ΠΘ§…ζ≥…Β»ΧεΜΐΒΡCO2ΚΆΥ°’τΤχΘ§Ζ¥”ΠΚσΜλΚœΤχΧεΒΡΟήΕ»ΫœΖ¥”Π«ΑΦθ…ΌΝΥ![]() (Ψυ‘ΎœύΆ§ΧθΦΰœ¬≤βΕ®)Θ§‘ρΗΟ”–ΜζΈοΒΡΖ÷Ή” ΫΈΣ (ΓΓΓΓ)
(Ψυ‘ΎœύΆ§ΧθΦΰœ¬≤βΕ®)Θ§‘ρΗΟ”–ΜζΈοΒΡΖ÷Ή” ΫΈΣ (ΓΓΓΓ)
A.C2H4B.C3H6O2C.C2H4O2D.C4H8O2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≈π«βΜ·ΡΤΘ®NaBH4Θ©‘ΎΜ·ΙΛΒ»Νλ”ρΨΏ”–÷Ί“ΣΒΡ”Π”ΟΦέ÷ΒΘ§Ρ≥―–ΨΩ–ΓΉι≤…”ΟΤΪ≈πΥαΡΤNaBO2ΈΣ÷ς“Σ‘≠Νœ÷Τ±ΗNaBH4Θ§ΤδΝς≥Χ»γœ¬ΘΚ

“―÷ΣΘΚNaBH4≥ΘΈ¬œ¬Ρή”κΥ°Ζ¥”ΠΘ§Ω…»ή”Ύ“λ±ϊΑΖΘ®Ζ–ΒψΘΚ33ΓφΘ©ΓΘ
Θ®1Θ©‘ΎΒΎΔΌ≤ΫΖ¥”ΠΦ”Νœ÷°«ΑΘ§–η“ΣΫΪΖ¥”ΠΤςΦ”»»÷Ν100Γφ“‘…œ≤ΔΆ®»κκ≤ΤχΘ§ΗΟ≤ΌΉςΒΡΡΩΒΡ «_____Θ§‘≠Νœ÷–ΒΡΫπ τΡΤΆ®≥Θ±Θ¥φ‘Ύ____÷–Θ§ Β―ι “»Γ”Ο…ΌΝΩΫπ τΡΤ–η“Σ”ΟΒΫΒΡ Β―ι”ΟΤΖ”–_____Θ§_____Θ§≤ΘΝßΤ§ΚΆ–ΓΒΕΒ»ΓΘ
Θ®2Θ©«κ≈δΤΫΒΎΔΌ≤ΫΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚΓθNaBO2+ΓθSiO2+ΓθNa+ΓθH2=ΓθNaBH4+ΓθNa2SiO3 ______________
Θ®3Θ©ΒΎΔΎ≤ΫΖ÷άκ≤…”ΟΒΡΖΫΖ® «______ΘΜΒΎΔέ≤ΫΖ÷άκΘ®NaBH4Θ©≤ΔΜΊ ’»ήΦΝΘ§≤…”ΟΒΡΖΫΖ® «______ΓΘ
Θ®4Θ©NaBH4Θ®sΘ©”κΥ°Θ®lΘ©Ζ¥”Π…ζ≥…NaBO2Θ®sΘ©ΚΆ«βΤχΘ®gΘ©Θ§‘Ύ25ΓφΘ§101kPaœ¬Θ§“―÷ΣΟΩœϊΚΡ3.8ΩΥNaBH4Θ®sΘ©Ζ≈»»21.6kJΘ§ΗΟΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ Ϋ «_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ[Μ·―ßΓΣΓΣ―Γ–ό3ΘΚΈο÷ ΫαΙΙ”κ–‘÷ ]ΧΦΦΑΤδΜ·ΚœΈοΙψΖΚ¥φ‘Ύ”ΎΉ‘»ΜΫγ÷–Θ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©¥Π”Ύ“ΜΕ®Ω’Φδ‘ΥΕ·Ή¥Χ§ΒΡΒγΉ”‘Ύ‘≠Ή”ΚΥΆβ≥ωœ÷ΒΡΗ≈¬ ΟήΕ»Ζ÷≤ΦΩ…”Ο___________–ΈœσΜ·Οη ωΓΘ‘ΎΜυΧ§‘≠Ή”÷–Θ§ΚΥΆβ¥φ‘Ύ______Ε‘Ή‘–ΐœύΖ¥ΒΡΒγΉ”ΓΘ
Θ®2Θ©ΧΦ‘Ύ–Έ≥…Μ·ΚœΈο ±Θ§ΤδΦϋ–Ά“‘Ι≤ΦέΦϋΈΣ÷ςΘ§‘≠“ρ «_____________ΓΘ
Θ®3Θ©CS2Ζ÷Ή”÷–Θ§Ι≤ΦέΦϋΒΡάύ–Ά”–_____________Θ§C‘≠Ή”ΒΡ‘”Μ·ΙλΒάάύ–Ά «_______Θ§–¥≥ωΝΫΗω”κCS2ΨΏ”–œύΆ§Ω’ΦδΙΙ–ΆΚΆΦϋΚœ–Έ ΫΒΡΖ÷Ή”ΜράκΉ”_______________ΓΘ
Θ®4Θ©COΡή”κΫπ τFe–Έ≥…Fe(CO)5Θ§ΗΟΜ·ΚœΈοΒΡ»έΒψΈΣ253KΘ§Ζ–ΒψΈΣ376KΘ§ΤδΙΧΧε τ”Ύ_____ΨßΧεΓΘ
ΧΦ”–Εύ÷÷Ά§ΥΊ“λ–ΈΧεΘ§Τδ÷– ·ΡΪœ©”κΫπΗ’ ·ΒΡΨßΧεΫαΙΙ»γΆΦΥυ ΨΘΚ
ΔΌ‘Ύ ·ΡΪœ©ΨßΧε÷–Θ§ΟΩΗωC‘≠Ή”Ν§Ϋ”_____ΗωΝυ‘ΣΜΖΘ§ΟΩΗωΝυ‘ΣΜΖ’Φ”–___ΗωC‘≠Ή”ΓΘ
ΔΎ‘ΎΫπΗ’ ·ΨßΧε÷–Θ§C‘≠Ή”ΥυΝ§Ϋ”ΒΡΉν–ΓΜΖ“≤ΈΣΝυ‘ΣΜΖΘ§ΟΩΗωC‘≠Ή”Ν§Ϋ”________ΗωΝυ‘ΣΜΖΘ§Νυ‘ΣΜΖ÷–ΉνΕύ”–________ΗωC‘≠Ή”‘ΎΆ§“ΜΤΫΟφΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”–ΙΊΨßΧεΒΡ–π ω÷–’ΐ»ΖΒΡ «Θ® Θ©
AΘ°‘ΎSiO2ΨßΧε÷–Θ§”…SiΓΔOΙΙ≥…ΒΡΉν–ΓΒΞ‘ΣΜΖ÷–Ι≤”–8Ηω‘≠Ή”
BΘ°‘Ύ28gΨßΧεΙη÷–Θ§Κ§Si©¹SiΙ≤ΦέΦϋΗω ΐΈΣ4NA
CΘ°ΫπΗ’ ·ΒΡ»έΖ–ΒψΗΏ”ΎΨßΧεΙηΘ§ «“ρΈΣC©¹CΦϋΦϋΡή–Γ”ΎSi©¹SiΦϋ
DΘ°ΟΨ–ΆΚΆΆ≠–ΆΫπ τΨßΧεΒΡ≈δΈΜ ΐΨυΈΣ12
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪΧζΖέΚΆΜν–‘ΧΩΒΡΜλΚœΈο”ΟNaCl»ή“ΚΫΰ»σΚσΘ§÷Ο”Ύ»γΆΦΉΑ÷Ο÷–Θ§Ϋχ––ΧζΒΡΒγΜ·―ßΗ· ¥ Β―ιΓΘœ¬Ν–”–ΙΊΗΟ Β―ιΒΡΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
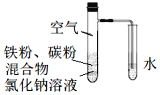
A.Χζ±Μ―θΜ·ΒΡΒγΦΪΖ¥”Π ΫΈΣFe®C3e=Fe3+
B.ΧζΗ· ¥Ιΐ≥Χ÷–Μ·―ßΡή»Ϊ≤ΩΉΣΜ·ΈΣΒγΡή
C.Μν–‘ΧΩΒΡ¥φ‘ΎΜαΦ”ΥΌΧζΒΡΗ· ¥
D.“‘Υ°¥ζΧφNaCl»ή“ΚΘ§Χζ≤ΜΡήΖΔ…ζΈϋ―θΗ· ¥
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ2-±ΫΜυ±ϊœ©Υα(ΥΉΟϊΑΔΆ–Υα) «“Μ÷÷÷Ί“ΣΒΡ“Ϋ“©÷–ΦδΧεΓΔ≤ΡΝœ÷–ΦδΧεΘ§Ω…”Οœ¬Ν–ΖΫΖ®Κœ≥…ΓΘ Ήœ»Θ§”…A÷ΤΒΟEΘ§Ιΐ≥Χ»γœ¬ΘΚ
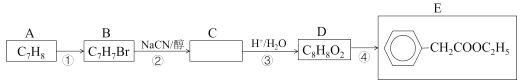
“―÷ΣΘΚi.CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
ii.CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
Θ®1Θ©ΧΰAΒΡΟϊ≥Τ «___ΓΘDΒΡΆ§Ζ÷“λΙΙΧε÷–Θ§ΡήΖΔ…ζ“χΨΒΖ¥”ΠΒΡΖΦœψΉεΜ·ΚœΈο”–Εύ÷÷Θ§»Έ–¥“Μ÷÷ΗΟάύΆ§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ Ϋ___ΓΘ–¥≥ωΖ¥”ΠΔήΒΡΜ·―ßΖΫ≥Χ Ϋ___ΓΘ
”÷“―÷ΣΘ§iiiΘΚRΓΣCH2ΓΣCOOCH2RΓ·+HCOOCH2RΓ±![]() +RΓ±ΓΣCH2OH
+RΓ±ΓΣCH2OH
»ΜΚσΘ§Ά®Ιΐœ¬Ν–¬ΖœΏΩ…ΒΟΉν÷’≤ζΤΖΘΚ
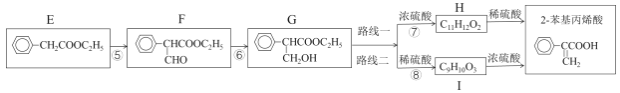
Θ®2Θ©Φλ―ιF «ΖώΆξ»ΪΉΣΜ·ΈΣGΒΡ ‘ΦΝ «___ΓΘΖ¥”ΠΔίΒΡΜ·―ßΖΫ≥Χ Ϋ «___ΓΘ
Θ®3Θ©¬ΖœΏΕΰ”κ¬ΖœΏ“Μœύ±»≤ΜΧΪάμœκΘ§άμ”… «___ΓΘ
Θ®4Θ©…ηΦΤ≤ΔΆξ…Τ“‘œ¬Κœ≥…Νς≥ΧΆΦ___ΓΘ
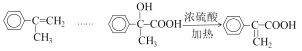
Θ®Κœ≥…¬ΖœΏ≥Θ”ΟΒΡ±μ ΨΖΫ ΫΈΣΘΚA![]() BΓ≠Γ≠
BΓ≠Γ≠![]() ΡΩ±ξ≤ζΈοΘ©
ΡΩ±ξ≤ζΈοΘ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Έ¬Ε»œ¬Θ§wgΡ≥Έο÷ ‘ΎΉψΝΩ―θΤχ÷–≥δΖ÷»Φ…’Θ§Τδ»Φ…’≤ζΈοΝΔΦ¥”κΙΐΝΩΒΡNa2O2Ζ¥”ΠΘ§ΙΧΧε÷ ΝΩ‘ωΦ”wgΓΘ‘ΎΔΌH2ΘΜΔΎCOΘΜΔέCOΚΆH2ΒΡΜλΚœΈο ΔήHCHOΘΜΔίCH3COOHΘΜΔόHO-CH2-CH2-OH÷–Θ§ΖϊΚœΧβ“βΒΡ «
A. Ψυ≤ΜΖϊΚœ B. ÷Μ”–ΔΌΔΎΔέ C. ÷Μ”–ΔήΔί D. »Ϊ≤ΩΖϊΚœ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com