
| A、①③ | B、②④ |
| C、①②④ | D、②③④ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、pH=12的溶液:Ca2+、NH4+、Br-、HSO3- |
| B、无色溶液:K+、Al3+、HCO3-、Cl- |
| C、通入H2S无沉淀:Cu2+、Na+、I-、SO42- |
| D、c(H+)=1×10-2mol/L的溶液:Fe3+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | ||
| T | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2含有NA个氧原子 |
| B、标准状况下,11.2L SO3中含有的分子数为0.5NA |
| C、1mol Cl2做氧化剂转移的电子数是NA |
| D、1L0.1mol?L-1的氨水中含OH-离子数为0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
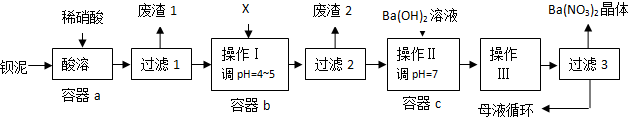
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com