
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: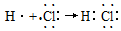 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe2++Fe3++4H2O | |
| C. | 将金属铝加入NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去 | |
| C. | 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生 | |
| D. | 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2CH2OH+HBr $\stackrel{△}{→}$CH3CH2CH2Br+H2O | |
| B. | 服用阿司匹林过量出现水杨酸(  )中毒反应,可静脉注射 NaHCO3溶液: )中毒反应,可静脉注射 NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向丙氨酸钠中加入足量盐酸: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁和稀盐酸反应:S2-+2 H+→H2S↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com