
| A. | 氮的固定包括人工固氮和自然固氮 | B. | 工业合成氨属于人工固氮 | ||
| C. | 自然固氮中氮元素被氧化 | D. | 氮的固定中参与元素至少有两种 |
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、HCO3- | |
| B. | 使pH试纸显蓝色的溶液:K+、Cu2+、Cl-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液:Na+、NH4+、ClO4-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol/L的溶液:K+、NH4+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的硫酸 | B. | 0.01mol/L的硝酸 | C. | 0.01mol/L的甲酸 | D. | pH=2的醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | |
| B. | W的最高价氧化物对应的水化物酸性比R的强 | |
| C. | W与X形成的是离子化合物 | |
| D. | W的气态氢化物的热稳定性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了探究蔗糖的甜味,从试剂瓶中取少量进行品尝 | |
| B. | 酒精灯不用时可用扇子扇灭 | |
| C. | 发现家中煤气泄漏时,先开窗不能开灯 | |
| D. | 往浓硫酸中加一定量水即可得到稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
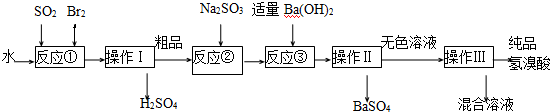
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,0.3mol NaHSO4固体中含有的离子数目为0.6NA | |
| B. | 2L0.1mol•L-1Al2(SO4)3溶液中,Al3+的目为0.4NA | |
| C. | 标准状况下,4.48L O2所含有的共用电子对数目为0.2NA | |
| D. | 0.3mol Na2O2与盐酸反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸 | B. | 氢硫酸 | C. | 硝酸 | D. | 碘化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
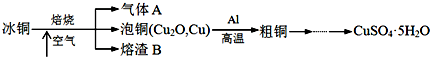
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com