
【题目】将0.1mol MnO2加到10mL过氧化氢(H2O2)的水溶液里(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图:
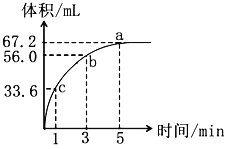
(1)a、b、c三点反应速率快慢顺序为_______,反应速率变化的可能原因是______________。
(2)计算过氧化氢的起始物质的量浓度是多少?_______________
(3)假设反应过程中溶液的体积保持不变,则用H2O2表示该反应1—3分钟内的平均速率为多少?_________________
【答案】a < b < c 随着反应的进行双氧水浓度越来越小 0.6mol/L 0.1mol/(L·min)
【解析】
(1)从影响化学反应速率的因素随着反应的进行双氧水浓度越来越小。
(2)根据c=n÷V计算;
(3)根据v=△c÷△t计算;
(1)a、b、c三点反应速率快慢顺序为a < b < c,反应速率变化的可能原因是随着反应的进行双氧水浓度越来越小。
故答案为:a < b < c,随着反应的进行双氧水浓度越来越小。
(2)由图可知双氧水分解后得到67.2mLO2,根据方程式:2H2O2=2H2O+O2↑,c(H2O2)=2×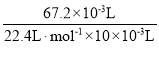 =0.6mol·L-1,即过氧化氢的起始物质的量浓度是0.6mol·L-1,故答案为:0.6mol·L-1;
=0.6mol·L-1,即过氧化氢的起始物质的量浓度是0.6mol·L-1,故答案为:0.6mol·L-1;
(3)假设反应过程中溶液的体积保持不变,则用H2O2表示该反应1—3分钟内的平均速率为:v=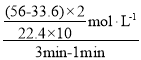 =0.1mol/(L·min),故答案为:0.1mol/(L·min)。
=0.1mol/(L·min),故答案为:0.1mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值。下列说法正确的是
A.1mol氨基含有的电子数为10 NA
B.标准状况下,22.4 L O2完全转化为Na2O2时转移的电子数为4 NA
C.56 g C3H6和C4H8的混合气体中含有的氢原子数为8 NA
D.0.1 mol·L-1CH3COONa溶液中CH3COO-、CH3COOH数目之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,其电池反应式为2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,则下列有关说法错误的是( )
2CO32-+6H2O,则下列有关说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O
D.充电时每生成1molCH3OH转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通迅、交通及日常生活中有着广泛的应用。
(1)如图是锌锰干电池的基本构造图。
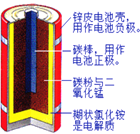
①该干电池工作时负极上的电极反应式是_______________MnO2的作用是除去正极上的产物H2,本身生成Mn2O3,该反应的化学方程式是______________。
②关于该电池的使用和性能,说法正确的是 (______)
A.该电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
D.外电路中每通过0.2mol电子,负极的质量理论上减小6.5g
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为: Cd +2NiO(OH)+2H2O 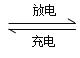 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸,以下说法正确的是 (______)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸,以下说法正确的是 (______)
A .以上反应是可逆反应 B.以上反应不是可逆反应
C. 电池放电时Cd 做负极 D. 电池放电时Cd 做正极
(3)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米的耕地失去使用价值。在酸性土壤中这种污染更为严重这是因为___________。
(4)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,一般使用时间可长达十年,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是

A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是______。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓HNO3反应,装置、现象如下:
实验装置 | 实验现象 |
| A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色。 B中:溶液呈淡蓝色。 |
①A中铜与浓HNO3产生红棕色气体的化学方程式是 ______。
②实验现象“最初反应较慢,随后加快”的原因可能是 ______。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。实验探究如下:
I:向 1 mL浓硝酸中加入几滴30% H2O2溶液、铜片,反应较慢,溶液呈蓝色。
II:向1 mL浓硝酸中加入几滴30% H2O2溶液,无明显变化。
①I中反应变慢的原因是 ______。
②NO2与H2O反应生成HNO2和 ______。
③对生成HNO2后反应变快的原因进行实验探究。
序号 | 实验操作 | 实验现象 |
III | 取B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
IV | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较Ⅲ慢;液面上方呈浅红棕色 |
a.III中加入的固体为______。
b.IV中“放置一段时间”的目的是 ______。
实验III、IV可以说明,HNO2氧化Cu的反应速率比HNO3氧化Cu的反应快。
(4)化学小组同学结合实验甲、乙中HNO3被还原后的气体产物以及实验III的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学分别用下列装置a和b制备溴苯,下列说法错误的是

A.两烧瓶中均出现红棕色气体,说明液溴沸点低
B.a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应
C.b装置试管中CCl4吸收Br2,液体变红棕色
D.b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
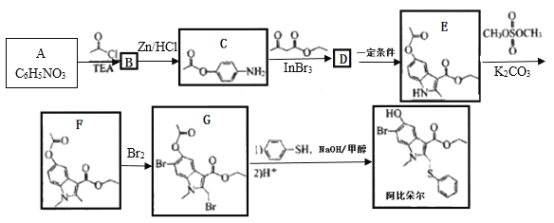
【题目】阿比朵尔可用于合成一种治疗新型冠状病毒肺炎的试用药物,实验室以芳香化合物A 为原料合成阿比朵尔的一种合成路线如下:
已知:![]()
请回答:
(1)A的化学名称为_________; B的结构简式为_________。
(2)阿比朵尔中含氧官能团的名称为________;由E生成F的反应类型为_______。
(3)由C生成D的化学方程式为___________。
(4)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器为 ___(填选项字母)。
A. 质谱仪 B. 红外光谱仪 C. 元素分析仪 D. 核磁共振仪
同时满足下列条件的C的同分异构体有_____种(不考虑立体异构)。
①苯环上连有-NH2 ②能发生水解反应和银镜反应
(5)参照上述合成路线,设计以苯和丁酮( ![]() ) 为原料制备
) 为原料制备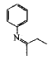 的合成路线(无机试剂任选):________________________________。
的合成路线(无机试剂任选):________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com